Detección de lesiones preneoplásicas en el epitelio de la mucosa bronquial, en el proceso de carcinogénesis pulmonar de pacientes fumadores
Resumen
Objetivo: Determinar las alteraciones histopatológicas a nivel de mucosa bronquial de pacientes fumadores. Materiales y métodos: 100 biopsias de la mucosa bronquial obtenidas por broncofibroscopia de pacientes fumadores, con diagnóstico de algún tipo de patología respiratoria, en el periodo comprendido de marzo de 2008 a marzo de 2012.
Resultados: edad promedio de los pacientes estudiados fue de 59.30 años ± 7.6, el 90% de los pacientes tenía más de 50 años, hubo predominio en el grupo masculino, representando por el 72% de la muestra. Índice paquetes-años el mayor número de alteraciones histopatológico de la mucosa bronquial se observó en el rango de 60 a 120 paquetes-años, el 9% de los casos reporto células neoplásicas. En cuanto a la localización anatomo-endoscópica de la muestra de la mucosa endobronquial el 80% de los casos se reportaron alteraciones de su epitelio. En tracto respiratorio derecho 51%, con el 5% células neoplásicas en los casos. El 29% en el tracto bronquial izquierdo, en donde las alteraciones del epitelio tipo células neoplásicas en el 5% de los casos. En la visualización endoscópica, el engrosamiento con disminución de la luz endobronquial, fue donde se reportó las 10 biopsias con alteraciones para células neoplásicas. En los casos que con células neoplásicas 5% para el carcinoma de células escamosas, 3% carcinoma de células pequeñas y 2% para el adenocarcinoma.
Conclusiones: en la mucosa bronquial de los pacientes fumadores se producen alteraciones estructurales y funcionales en el epitelio bronquial como alteraciones de los cilios, hiperplasia de células basales o caliciformes, con metaplasia escamosa, displasia y carcinoma in situ, las cuales se consideran lesiones precursoras (precancerosas) de la mucosa bronquial.
Palabras clave: Lesiones precancerosas. Mucosa bronquial. Pacientes fumadores.
Introducción
Las vías respiratorias están revestidas por un epitelio cilíndrico pseudoestratificado constituido por células ciliadas, células caliciformes secretoras de moco y células basales (stem).1,2 En condiciones normales las células ciliadas constituyen el tipo celular predominante, aunque se detectan variaciones en las distintas regiones de la vía respiratoria, así como cambios asociados con la edad. El revestimiento epitelial de las vías respiratorias, conjuntamente con el transporte mucociliar, forman parte de la primera línea de defensa del aparato respiratorio.3, 4
Las alteraciones histopatológicas del epitelio se asocian con una amplia variedad de enfermedades respiratorias y resultan también de la exposición a agentes ambientales irritantes, y principalmente a la exposición acentuada o consecutiva producto del hábito tabáquico, debido a que el tabaco contiene más de 4.000 sustancias químicas activas que pueden provocar alteración en la mucosa bronquial de los fumadores.
La interacción entre estas sustancias y las estructuras celulares es compleja y variable en cada individuo que se exponga de forma prolongada a estas sustancias lo que puede justificar la distinta susceptibilidad y diversidad de alteraciones observadas en los pacientes fumadores. Las repercusiones clínicas de las afecciones epiteliales han sido subestimadas, pero actualmente se acepta que las mismas generan un círculo vicioso que favorece la cronicidad de muchas afecciones respiratorias. Los cambios histológicos en la mucosa bronquial de los pacientes fumadores se consideran como lesiones precursoras o precancerosas, a los cambios morfológicos celulares que pueden conducir a pasos intermedios previos al desarrollo de la neoplasia maligna.
Las lesiones preneoplásicas de extirpe escamosa son la displasia leve, moderada y severa y el carcinoma in situ, las del adenocarcinoma son: hiperplasia adenomatosa atípica (HAA) y adenocarcinoma in situ (no-mucinoso, mucinoso y mixto) y la del tumor carcinoide sería la hiperplasia pulmonar neuroendocrina difusa idiopática (HPNDI). No se conoce qué lesión preneoplásica precede al carcinoma de células pequeñas.3, 4
Los cambios morfológicos en el epitelio bronquial incluyen:4 Hiperplasia, que se caracteriza por incremento en el número de células basales, células caliciformes o de ambas que condiciona engrosamiento y desequilibrio del epitelio, con predominio del componente proliferativo sobre el maduro ciliado superficial. Metaplasia escamosa, proceso que se desarrolla sobre el anterior, con sustitución del epitelio superficial pseudoestratificado ciliado, por un epitelio más resistente como es el escamoso poliestratificado. Si bien este epitelio es anómalo, su morfología no muestra rasgos atípicos. Displasia. Cuando el epitelio escamoso metaplásico comienza a sufrir alteraciones citológicas se habla de cambios displásicos que, según la extensión del “desorden tisular”, será de carácter:
- Leve: grado inicial de displasia, que consiste en una simple distorsión epitelial del área metaplásica,
- Moderada: la OMS no define de forma exacta esta fase intermedia, dejando a una evidente subjetividad su diagnóstico,
- Severa: esta lesión muestra cambios histológicos de evidente proliferación, con marcado engrosamiento del espesor epitelial e incremento del tamaño celular, con anisocitosis y pleomorfismo. Aumento nuclear que se dispone verticalmente en las capas profundas con atipia e imágenes de mitosis y
- carcinoma in situ.
Las alteraciones citológicas e histológicas mencionadas alcanzan su máxima expresión, siendo la lesión preneoplásica de mayor alteración epitelial escamosa. Todo el espesor del epitelio está reemplazado por células atípicas y mitosis, habitualmente es un foco pequeño, con irregularidades y discontinuidades evidentes de la membrana basal, aunque sin traspasarla, es decir, sin objetivarse invasión.
En la mucosa adyacente al carcinoma in situ hay frecuentemente signos de displasia y metaplasia. Tanto la hiperplasia como la metaplasia escamosa representan cambios reactivos comunes y no son considerados cambios que progresen a la malignidad. En cambio, la displasia de carácter moderado-severo son verdaderas lesiones preneoplásicas, considerándose de alto grado de futura malignidad.3, 4,5
Todas estas alteraciones celulares se comportan como pasos intermedios hacia el desarrollo de la neoplasia maligna, ya que representan los cambios en el epitelio bronquial en relación a la irritación crónica producida por el tabaco y su evolución natural conduce al carcinoma escamoso, aunque en un porcentaje elevado de casos el epitelio regresa a la normalidad. Estas lesiones precursoras no poseen capacidad de invasión ya que no afectan a la membrana basal y por tanto, no pueden progresar por la vía linfática.6
En las lesiones de la vía aérea, agrupamos aquellas lesiones de la mucosa bronquial, referidas siempre al componente epitelial y que podemos considerarlas como una progresión desde la primera, más simple, a la más agresiva.7 Es por ello que una neoplasia es una alteración que conlleva a la formación de un nuevo modelo celular y este nuevo modelo además de cambiar la forma presenta una conducta anómala que se manifiesta sobre todo por un crecimiento desordenado. El crecimiento desordenado puede ser de dos tipos:
- Crecimiento inicial localizado, en forma de masa que se conoce generalmente como tumor, ya que se produce una hinchazón, y esta puede dar lugar a tumores benignos que son aquellos que permanecen localizados y no se infiltran a los tejidos adyacentes, o puede dar lugar a tumores malignos que infiltran y destruyen el tejido vecino o se diseminan a través del torrente circulatorio, y
- un crecimiento inicial diseminado.7,8
Existen precursores en la aparición de las células neoplásica que pueden estar dadas por estímulos de diferentes clases, lo que pueden provocar varias respuestas por parte del tejido, entre estas respuestas tenemos a la hiperplasia que es una alteración reversible, que por si misma no constituye un cambio preneoplásico, produce un aumento del número de células y puede dar lugar a cierto grado de distorsión de la citología y la arquitectura tisular de la zona, lo que se conoce como atipia, la metaplasia que también es una alteración reversible de la mucosa que se desarrolla sobre el tejido previo, con sustitución del epitelio superficial, ciliado por un epitelio más resistente como es el escamoso poliestratificado y la cual no es preneoplásica en sí misma, es decir consiste en un cambio de tipo celular, de forma que pasa a tener características celulares de otra zona del cuerpo, si bien este nuevo epitelio es anómalo, su morfología no muestra rasgos atípicos, y la displasia que es una distorsión de la arquitectura epitelial del área metaplásica, que es irreversible y pre neoplásica, puede ser displasia leve, moderada o grave.
Esta última se identifica como cambios citológicos de evidente proliferación, con atipia e imágenes de mitosis, siendo difícil de separar del carcinoma.7, 8, 9,10 El Carcinoma in situ, es la lesión de máxima alteración epitelial escamosa, siempre en la superficie, sin superar la membrana basal.
La introducción del broncoscopio flexible o fibrobroncoscopio por Ikeda,11 en 1968, se convirtió en la piedra angular de los procedimientos diagnósticos en las diferentes patologías del árbol bronquial especialmente en las lesiones pre neoplásicas de la mucosa. La observación endoscópica sobre zonas con apariencia sana, no siempre asegura que así lo sean, la mucosa endobronquial puede estar presentado distorsión en la arquitectura de las células epiteliales con rasgos atípicos o no, que pueden ser detectables no a la visión endoscópica.
Es por esto que a todo paciente con antecedente de tabaquismo, a los que se les realiza broncofibroscopía flexible. Es por esto que a todo paciente con antecedente de tabaquismo, a los que se les realiza broncofibroscopía flexible se le debe practicar toma de biopsia, cepillado y aspirado bronquial. Debido a que en los casos de carcinoma bronquial manifiesto en las zonas vecinas se encuentran hiperplasia y metaplasia casi en el 90% de los casos, displasia en alrededor del 40% y carcinoma in situ en 20-30%. El tiempo de transformación calculado citológicamente para la fase displasia moderada-carcinoma invasor es de 3.2 años. Hoy en día se considera que el hallazgo de una lesión preneoplásica puede ser un marcador de riesgo elevado de cáncer de pulmón en pacientes expuesto al humo del tabaco.
Materiales y métodos
El presente estudio fue realizado sobre 100 biopsias de la mucosa bronquial, de pacientes fumadores, ingresados por los Servicios de Medicina Interna, Neumonologia y Cirugía de Tórax, con diagnóstico de algún tipo de patología respiratoria y con antecedentes de tabaquismo. Los cuales fueron referidos a través de interconsulta al Servicio de Endoscopia respiratoria del Hospital Dr. Adolfo Pons de Maracaibo del IVSS, en el periodo comprendido de marzo de 2008 a marzo de 2010.
A todos los pacientes se les practicó broncofibroscopía en la sala de endoscopia, previa anestesia local a nivel de orofaringe con xylocaína en spray al 10%, asimismo se empleó pre medicación con atropínicos, no se usó psicotrópicos, ningún caso fue menester de anestesia general. Se utilizó broncofibroscopio Olympus CLU-4U mediante abordaje vía orofaringea, para realizar biopsia de mucosa bronquial (3 a 5 muestras) a nivel de la carina principal, carinas interlobares de los bronquios superior e inferior derecho e izquierdo y carinas intersegmentarias del bronquio intermedio, con pinza FB-19C.
Las muestras de las biopsias., se fijaron en formol al 10% y fueron incluidas en parafina, para realizar cortes de 7 micras que fueron teñidos con hematoxilina eosina (H-E), en total se realizaron 6 cortes por biopsia. Se utilizó microscopio óptico Zeiss con objetivo 40x y ocular 10x. En las biopsias se evaluaron las características del epitelio, membrana basal, corion y fibras musculares lisas.
El diseño de la investigación fue prospectivo, descriptivo y analítico donde los valores obtenidos fueron tratados mediante un análisis centrado en las variables: sexo, edad, habito tabáquico, localización anatomo-endoscópica y alteraciones visualizadas en la endoscopia. Los datos son procesados en número y porcentaje.
Resultados
En los 100 casos de pacientes con antecedentes de hábitos tabáquicos a los cuales se les tomo biopsia de la mucosa enbronquial para determinar los cambios histológicos y/o las lesiones pre neoplásicas existente. La edad promedio de los pacientes estudiados fue de 59.30años ± 7.6, el 90% de los pacientes tenía más de 50 años, siendo la sexta década de la vida donde se presentó el mayor número de pacientes estudiados, en cuanto a los resultados de la biopsia endobronquial y la edad, el 10% presentaron metaplasia, 44% presentaban hiperplasia, 16% displasia, positivo para células neoplásicas el 10% de los casos, en el 20% de los pacientes la biopsia se reportó normal.
[su_spacer size=”30″]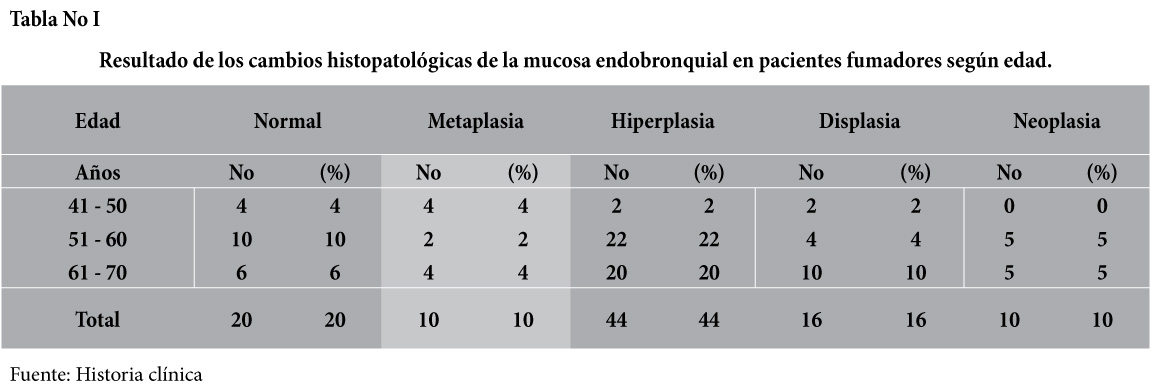 [su_spacer size=”30″]
[su_spacer size=”30″]
En cuanto la variable sexo, hubo predominio en el grupo masculino, representando por el 72% de la muestra. En los resultados obtenidos de la relación sexo y resultado de la biopsia endobronquial, siguió el predominio del sexo masculino en donde el reporte histológico, fue en el 7.0% metaplasia, 32% hiperplasia, 12% displasia y positivo para células neoplásicas en el 8.0% de los casos. Asimismo en el 15% de los pacientes el reporte de la biopsia fue normal.
[su_spacer size=”30″]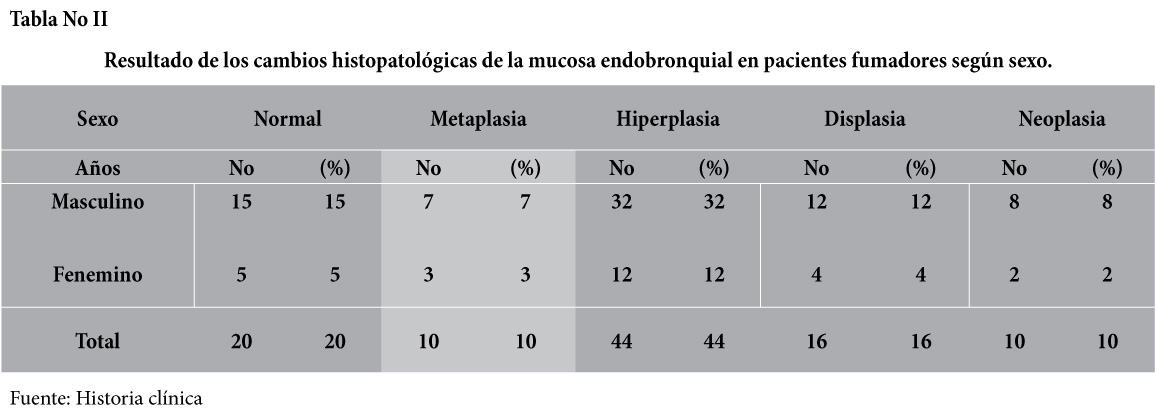 [su_spacer size=”30″]
[su_spacer size=”30″]
Según el número de cigarrillos fumados al día, los fumadores tienen un riesgo de 10 a 20 veces mayor de desarrollar alteraciones anormales en las células de la mucosa bronquial. Por lo que existe hoy en día una relación dosis-respuesta lineal. En la actualidad se usa el índice cajetillas-años como medidor de intensidad tabáquica, el cual se obtiene a partir del número de cajetillas fumadas al día x número de años fumando.12
En relación al índice cajetilla-año para medir la intensidad tabáquica, el hábito de fumar cigarrillos, se relacionó de acuerdo al número de años y número de cajetillas fumadas al día, en cuanto a número de años fumando todos los pacientes tenían más de treinta años con el hábito. Con respecto al índice cajetillas-años: en mayor número de alteraciones histopatológico de la mucosa bronquial se observó en el rango de 60 a 120 cajetillas-años, el 9% de los casos fue positivo para células neoplásicas, metaplasia 10%, hiperplasia 42%, displasia 14% y en el 17% resultado de la mucosa es normal.
[su_spacer size=”30″]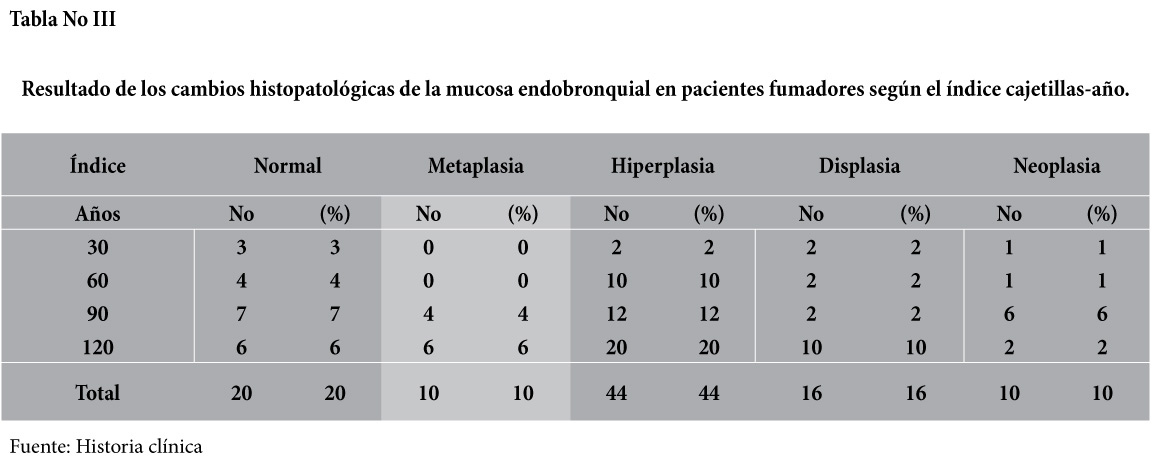 [su_spacer size=”30″]
[su_spacer size=”30″]
Lo que determina que entre más años de la vida haya fumado una persona y sobre todo si es a una edad temprana, está más relacionado con la proliferación de células anormales que hoy en día se consideran alteraciones preneoplásicas. En cuanto a la localización anatomo-endoscópica se tomaron muestra de biopsia de la mucosa de las carina de los bronquios fuentes lobares, tanto del árbol bronquial del Pulmón derecho como del árbol bronquial del pulmón izquierdo en el 100% de los casos.
En la muestra de la mucosa endobronquial en el 80% de los casos se reportaron alteraciones histopatológico.
El tracto bronquial derecho se reportaron un 51%, de los casos, de los cuales 33% se reportó en el lóbulo superior (LSD) con alteraciones histológicas del epitelio; 20% hiperplasia, 6% displasia, 4% metaplasia, y 3% células neoplásicas. Mientras que el lóbulo inferior (LID) fue el 18% de las alteraciones histológicas del epitelio fueron 12% hiperplasia, 4% displasia y 2% células neoplásicas.
[su_spacer size=”30″]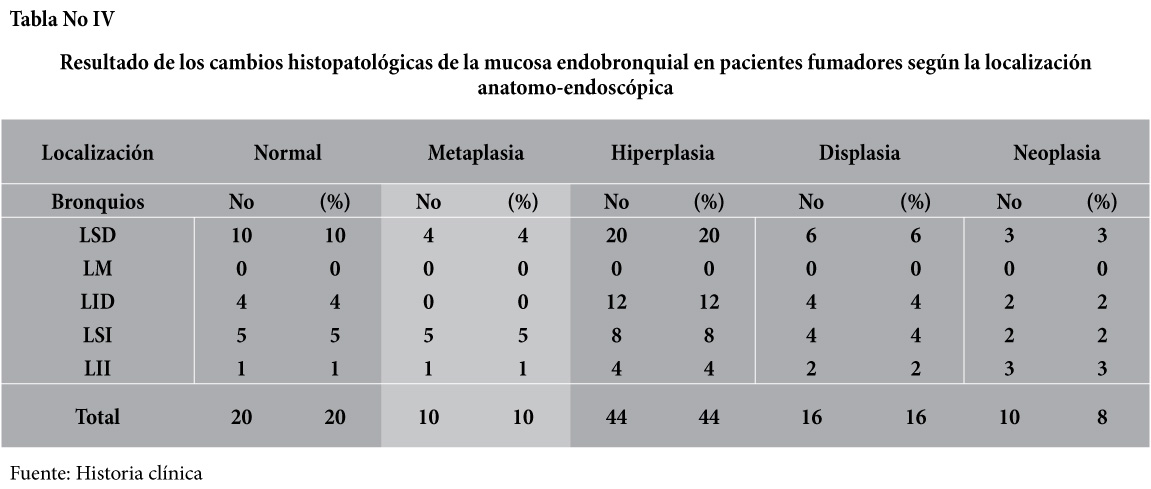 [su_spacer size=”30″]
[su_spacer size=”30″]
El 14% de las muestra de biopsia de la mucosa tomada del árbol bronquial derecho no presentaron alteraciones histopatológica. Por otra parte el 29% de los casos, le correspondió al tracto bronquial izquierdo, en donde se detectaron cambios en la mucosa del bronquio fuente de lóbulo superior 5% metaplasia, 8% hiperplasia, 4% displasia y 2% para células neoplásicas. Para la mucosa del bronquio fuente del lóbulo inferior el reporte fue 1% metaplasia, 4% hiperplasia, 2% displasia y 3% células neoplásicas. Mientras que en el 6% de las muestras no hubo alteraciones histopatológica de la mucosa del árbol bronquial.
Según las alteraciones de la mucosa enbronquial tanto del lado derecho como del izquierdo, visualizadas durante el procedimiento endoscópico y reportadas por el estudio histopatológico, de las 10 biopsias reportadas positiva para células neoplásicas, en 8 casos se reportaron en la mucosa del árbol bronquial derecho y 2 casos en la mucosa del árbol bronquial izquierdo, en donde la alteración visualizada durante la endoscopia era engrosamiento con disminución de la luz endobronquial, mientras que en el restante de los casos el 38% para hiperplasia, 10% para metaplasia y displasia. En el 20% de los casos el reporte de la biopsia de la mucosa no reporto ninguna alteración.
[su_spacer size=”30″]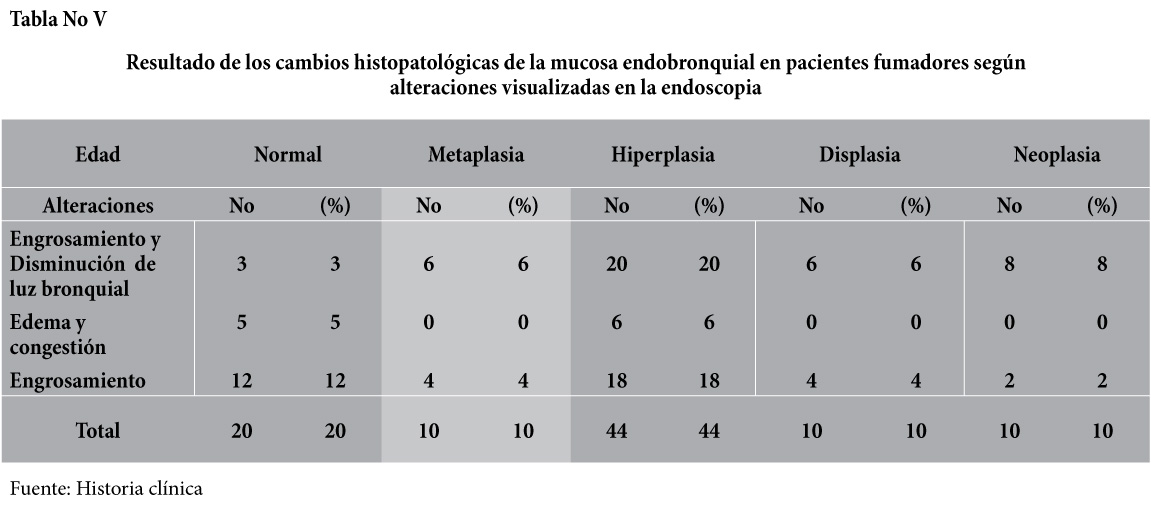 [su_spacer size=”30″]
[su_spacer size=”30″]
Por último, en los casos donde la biopsia fueron positivas para células neoplásicas, cuando se indago para ver el tipo de crecimiento tisular producto de esta proliferación de células anormales, es necesario tomar en cuenta que no existe ninguna evidencia de que el tabaquismo, esté asociado a una variedad histológica del cáncer broncogénico, sin embargo esta secuencia de cambios preneoplásico está bien definida para el carcinoma de células escamosa (carcinoma Epidermoide) y de células pequeñas, pero no tanto para los otros tipos histológico. Nuestro resultado se observó un predominio del carcinoma de células escamosa con cinco casos, seguidos del carcinoma de células pequeñas con tres casos.
[su_spacer size=”30″] [su_spacer size=”30″]
[su_spacer size=”30″]
Discusión
Por una parte el revestimiento epitelial de las vías respiratorias, conjuntamente con el transporte mucociliar, forman parte de la primera línea de defensa del aparato respiratorio. Las condiciones que alteran la integridad epitelial o afectan la eficiencia del transporte mucociliar conducen o favorecen la recurrencia de la enfermedad respiratoria. Por otra parte, las alteraciones histopatológicas del epitelio se asocian con una amplia variedad de enfermedades respiratorias y resultan también de la exposición a agentes irritantes como lo es el humo del cigarrillo.3,4,5
Los fumadores tienen un riesgo de 10 a 20 veces mayor de desarrollar alteraciones en la mucosa endobronquial producto de la proliferación de células anormales, según el número de cigarrillos fumados al día que los no fumadores. Es decir, hay una relación dosis-respuesta lineal. Actualmente se usa más el índice paquetes-año como medidor de intensidad tabáquica, obtenido a partir del número de cigarrillos fumados al día x años fumando /2012.
En los fumadores se producen alteraciones estructurales y funcionales en el epitelio bronquial como alteraciones de los cilios, hiperplasia de células basales y de células caliciformes, con metaplasia escamosa, displasia y carcinoma in situ, las cuales se consideran lesiones precursoras (precancerosas) de la mucosa bronquial. Se considera que las lesiones premalignas son cambios morfológicos celulares que pueden conducir a pasos intermedios previos al desarrollo de la neoplasia maligna. Este concepto se mezcla con el de lesiones preinvasiva y preneoplásica, siendo todos ellos sinónimos, desde el punto de vista morfológico.
El concepto de lesión preinvasiva ha evolucionado en las últimas décadas. Estas lesiones no se mencionaban en la clasificación de tumores pulmonares de la OMS del 1967, y en la clasificación histológica de la OMS del 1981 sólo se menciona la displasia escamosa y el carcinoma in situ. En el año 1999, la clasificación de la OMS describe 2 nuevas lesiones: hiperplasia adenomatosa atípica (AAH) y la hiperplasia pulmonar neuroendocrina difusa idiopática (HPNDI), sin existir nuevas aportaciones en la clasificación del año 2004 8. En la nueva clasificación del adenocarcinoma de pulmón del 2011 de la IASLC/ATS/ERS se añade el adenocarcinoma in situ (AIS) que se subdivide en tres tipos: no mucinoso, mucinoso y mixto como una lesión preinvasiva del adenocarcinoma.8, 9,10
La historia natural de las lesiones preneoplásicas no es bien conocida, sin embargo estas lesiones del epitelio bronquial se consideran precursoras del carcinoma broncogénico de tipo escamoso. Aunque su historia natural no es bien conocida, estudios longitudinales demuestran una alta prevalencia de estas lesiones en pacientes de riesgo;14, 15, 16,17 en cambio, la incidencia de carcinoma broncogénico es mucho menor.
Esto confirmaría que la mayoría de estas lesiones no evolucionan a carcinomas invasivos. Por tanto, aunque con las técnicas de broncoscopia actuales se pueden diagnosticar de forma precoz, su manejo sigue siendo un dilema. Para detectar las lesiones de localización central sería útil la citología de esputo y la broncoscopia de autofluorescencia y para diagnosticar las lesiones periféricas estaría indicada la Tomografía computada de tórax de alta resolución. Las técnicas de inmunohistoquímica permiten estudiar alteraciones genéticas y moleculares que determinan qué lesiones tienen más posibilidad de progresar a malignidad.16,17
En varios estudios revisados de la literatura en donde se intentan demostrar cuál sería la evolución de estas lesiones. Bota y cols.17, en un estudio prospectivo durante dos años en el que incluyen 104 pacientes, observan progresión solo en un 3,5% de las lesiones de bajo grado por lo que proponen solo seguimiento. En cambio, realizan tratamiento endobronquial en las displasias severas y en el carcinoma in situ.
Es el caso de Philip J y cols.,18 que realizan seguimiento a 22 pacientes con 53 lesiones durante un periodo de 12 a 85 meses. De las 36 lesiones de alto grado (displasia severa y carcinoma in situ), 6 progresaron a carcinomas invasivos y se diagnosticaron en total 11 tumores, 5 de ellos a distancia. Ellos concluyen que el riesgo de desarrollar un cáncer de pulmón en pacientes con lesiones de alto grado fue del 33% al año y del 54% a los dos años. En cambio, de las 17 lesiones de bajo grado (displasia leve y moderada), ninguna progresó a carcinomas invasivos. Anindo K y cols.,19 incluyen 22 pacientes y realizan seguimiento durante 22 meses.
Encontraron lesiones de alto grado en 16 pacientes y cinco progresaron en un periodo de 2 a 19 meses. Durante el seguimiento se diagnosticaron tres carcinomas a distancia de forma incidental,7 nuevas lesiones de alto grado y dos de bajo grado. Ninguna de las lesiones de bajo grado progresó a carcinomas invasivos y algunas de ellas regresaron de forma espontánea. En cambio, Breuer y cols.,20 observan progresión en 6 pacientes (9%) con displasia leve y moderada, así como en todos los carcinomas in situ durante un seguimiento de 21 meses.
Tomados en su conjunto, nuestros datos apoyan la idea de que las alteraciones epiteliales pueden ser una consecuencia de los desórdenes ciliares primarios a la injuria prolongada provocada por el hábito tabáquico. Estas alteraciones en la integridad epitelial afectan profundamente la eficiencia local del transporte mucociliar, generando un círculo vicioso que dificulta la regeneración del epitelio normal y favorece la aparición de lesiones consideradas como precursoras para neoplasias broncogenicas (metaplasia escamosa hiperplasia, displasia y carcinoma in situ) escamosa. En nuestra investigación los resultado en cuanto a la relación edad/sexo, es la sexta década de la vida con predominio de sexo masculino, con alteración de la mucosa bronquial para lesiones precursoras (precancerosas) en 80% de los casos.
Entre mayor exposición a tabaquismo el índice paquetes-años y alteraciones en la mucosa bronquial como lesiones precursoras, se observó en el rango de 60 a 120 paquetes-años, en el 75% de los casos, lo que demostró que entre más años de la vida haya fumado una persona está más propenso a cambios proliferativos de células anormales en su mucosa bronquial y que hoy en día se consideran alteraciones pre neoplásicas. La cuales estaban distribuidas en el 62% de los casos, en la mucosa bronquial del tracto bronquial derecho, mientras que el otro 32% se observó en tracto bronquial izquierdo.
De los 10 casos de las biopsias con neoplasia (carcinoma in situ), cuando se indago para ver el tipo de crecimiento tisular producto de esta proliferación de células anormales, se observó un predominio del carcinoma de células escamosa con cinco casos, seguidos del carcinoma de células pequeñas con tres casos y dos casos para el adenocarcinoma.
La mayoría de estudios coinciden en que solo una pequeña proporción de las lesiones de alto grado progresan a carcinomas invasivos, en cambio aparecen nuevas lesiones durante el seguimiento y el tiempo de progresión puede variar desde 2 meses a varios años. Para lesiones entre 5-10 mm se aconseja seguimiento por un periodo no inferior a 3 años. En el caso de lesiones mayores de 10 mm se aconseja resección. Y, si el hallazgo es de múltiples nódulos subsólidos de entre 5 y 10mm, también se aconseja seguimiento.19,20,21,22
No obstante, es difícil establecer comparaciones entre los estudios. El número de pacientes es escaso, la toma de biopsias y su repetición en la misma localización es difícil y algunos consideran que la toma de biopsias puede modificar la evolución de las lesiones. Por otro lado, la mayoría de los estudios hace referencia a las lesiones del epitelio bronquial, precursoras del carcinoma epidermoide, que representa solo una parte de los tumores pulmonares.
Conclusiones
En la mucosa bronquial de los pacientes fumadores se producen alteraciones estructurales y funcionales en el epitelio bronquial como alteraciones de los cilios, hiperplasia de células basales o caliciformes, con metaplasia escamosa, displasia y carcinoma in situ, las cuales se consideran lesiones precursoras (precancerosas) de la mucosa bronquial. La aparente indemnidad de la mucosa bronquial de los pacientes fumadores a la visión endoscópica, no contraindica la toma de biopsia de dicha mucosa bronquial, ya que como es sabido las alteraciones epiteliales pueden ser una consecuencia de los desórdenes originado por la injuria prolongada al tabaquismo.
La detección precoz de las alteraciones histopatológicas epiteliales y sus afecciones ciliares asociadas permiten evitar la instalación de formas epiteliales patológicas no ciliadas irreversibles, como la metaplasia escamosa.
Estos resultados, junto con los de otros estudios supondrán, sin duda, un cambio en el paradigma del cribado del cáncer de pulmón y estimularán esfuerzos para fomentar programas que permitan la detección precoz del cáncer de pulmón en todo el mundo en donde se debe incorporar programas de deshabituación tabáquica.
Bibliografía
- Fraser RS, Peter JA, Fraser RG, Pare PD. Diagnóstico de las enfermedades del Tórax. 2da Ed España: Marban; 1996.
- Breeze RG, Wheeldon EB. The cells of the pulmonary airways. Am Rev Respir Dis 1977; 116(4) pp: 705-77.
- Wright JL, Churg A. Smoking cessation decreases the number of metaplastic secretory cells in the small airways of the Guinea pig. Inhal Toxicol 2002; 14(11). pp: 1153-9.
- Kabir, Z y Bennett K, Clancy L.Lung cancer and urban air-pollution in dublin: a temporal association. 2007. Vol. 100 (2).pp: 367–369.
- Garber M, Troyanskaya O, Schluens K, Petersen S, Thaesler Z, Pacyna M, Van M, Rosen G, Perou C, Whyte R, Altman R, Brown P, Botstein D, and Peterseni.Diversity of gene expression in adenocarcinoma of the lung. 2001. Vol. 98.pp: 13784-13789.
- Ramírez, José. Clasificación histológica y lesiones preneoplásicas en cáncer de pulmón. Barcelona. 2005. pp: 85-87.
- Kerr KM, Carey FA, King G, Lamb D.Atypical alveolar hyperplasia: relationship with pulmonary adenocarcinoma, p53, and c-erb-2 expression. 1994. pp: 249–256.
- Jr., Patz EF.Imaging bronchogenic carcinoma. 2000. Vol. 117(4 suppl1).pp: 90S-5S.
- Montuenga, LM and Mulshine JL.New molecular strategies for early lung cancer detection. 2000. Vol. 18.pp: 555-63.
- Ikeda, S (1970) .Flexible broncofiberscpoe Ann Otol Rhinol laringol pp: 79:916
- Prior, JA. Cuidados respiratorios; Ed. Masson SALVAT Medicina, 1993
- Lung. In: Edge SB, Byrd DR, Compton CC, et al., eds.: AJCC Cancer Staging Manual. 7th ed. New York, NY: Springer, 2010, pp 253-70.
- Wistuba II, Mao L, Gazdar AF.Smoking molecular damage in bronchial epithelium. 2002. Vol. 21.pp: 7298-306.
- Sato M, Shames DS, Gazdar AF, Minna JD.A translational view of the molecular pathogenesis of lung cancer. 2007. Vol. 2.pp: 327-43.
- Sozzi G. Sard L, Gregorio L, Marchetti A, Musso K, Buttitta F, y cols.Association between cigarette smoking and FHIT gene alterations in lung cancer. 1997. Vol. 57.pp: 2121 – 2123.
- Viettro, L y Brauer,M Alteraciones histopatológicas del epitelio nasal en pacientes respiratorios crónicos Rev Med Uruguay 2005; 21: 122-129.
- Bota S, Auliac JB, Paris C, Metayer J, Sesboue R, Nouvet G, et al. Follow-up of bronchial precancerous lesions and carcinoma in situ using fluorescence endoscopy. Am J Respir Crit Care Med. 2001; 164: 1688-93.
- Jeremy Gerorge P, Banerjee AK, Read CA, O’Sullivan C, Falzon M, Pezzella F, et al. Surveillance for the detection of early lung cancer in patients with bronchial dysplasia.Thorax. 2007; 62 (1): 43-50.
- Banerjee AK, Rabbitts PH, George PJ. Preinvasive bronchial lesions: surveillance or intervention? Chest. 2004; 125 (5 Suppl): 95S-6S.
- Breuer RH, Pasic A, Smit EF, van Vliet E, Vonk Noordegraaf A, Risse EJ, et al. The natural course of preneoplastic lesions in bronchial epithelium. Clin Cancer Res. 2005; 11 (2 Pt 1):537-43.
Autores
Dr. Juan C. Araujo C.
Cirujano General y Cirujano de Tórax.
Facultad de Medicina.
Escuela de Medicina Universidad del Zulia
- Dr. Juan C. Araujo C.#molongui-disabled-link
- Dr. Juan C. Araujo C.#molongui-disabled-link
- Dr. Juan C. Araujo C.#molongui-disabled-link
- Dr. Juan C. Araujo C.#molongui-disabled-link

