Neumonía adquirida en la comunidad en pacientes pediátricos
La neumonía adquirida en la comunidad (NAC) es una infección aguda del parénquima pulmonar, cuyo diagnóstico usualmente requiere la evidencia en la historia clínica y en el examen físico.1, 2
La OMS define la neumonía adquirida en la comunidad, como la presencia de síntomas de tos y/o dificultad respiratoria. Considera la taquipnea como único signo predictor de neumonía, de acuerdo a la edad: 2 meses a 12 meses: > 50 respiraciones/min. De 12 meses a 5 años: > 40 respiraciones/min. En mayores de 5 años: > 28 respiraciones/min, con una sensibilidad 75% y especificidad 67%, comparado con la radiología de tórax.3
Es necesario el desarrollo de una historia clínica completa, que aporte todos aquellos aspectos de la enfermedad actual del niño, edad, esquema de vacunación, neumonías previas, uso reciente de antibióticos, refractariedad al tratamiento, condición social, estado inmunológico del paciente, asistencia a guarderías, viajes, frecuencia de exposición a enfermedades infecciosas. La presentación clínica varía según la edad, el microorganismo responsable (germen típico, atípico u oportunista), el estado nutricional e inmunitario del paciente y la presencia o no de comorbilidades.4
En los lactantes menores y mayores las infecciones virales son las más frecuentes con 77%, en comparación con los preescolares donde el porcentaje es de 59%. Las infecciones mixtas (bacterianas y virales) para ambos grupos de edad pueden ocurrir en un 36%; a diferencia de los escolares donde los gérmenes más frecuentes causantes de neumonía adquirida en la comunidad son las bacterias.5
Etiología
Aspectos generales
El diagnóstico etiológico de neumonía adquirida en la comunidad en pacientes pediátricos se determina generalmente por medio de pruebas de laboratorio, las que ofrecen una evidencia indirecta de la implicación causal de los microorganismos identificados.4
[su_spacer size=”30″]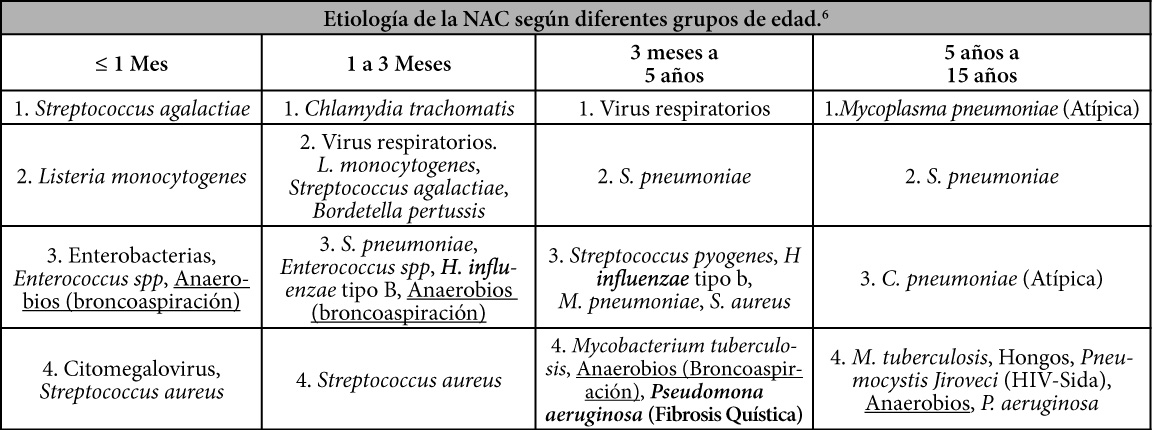 [su_spacer size=”30″]
[su_spacer size=”30″]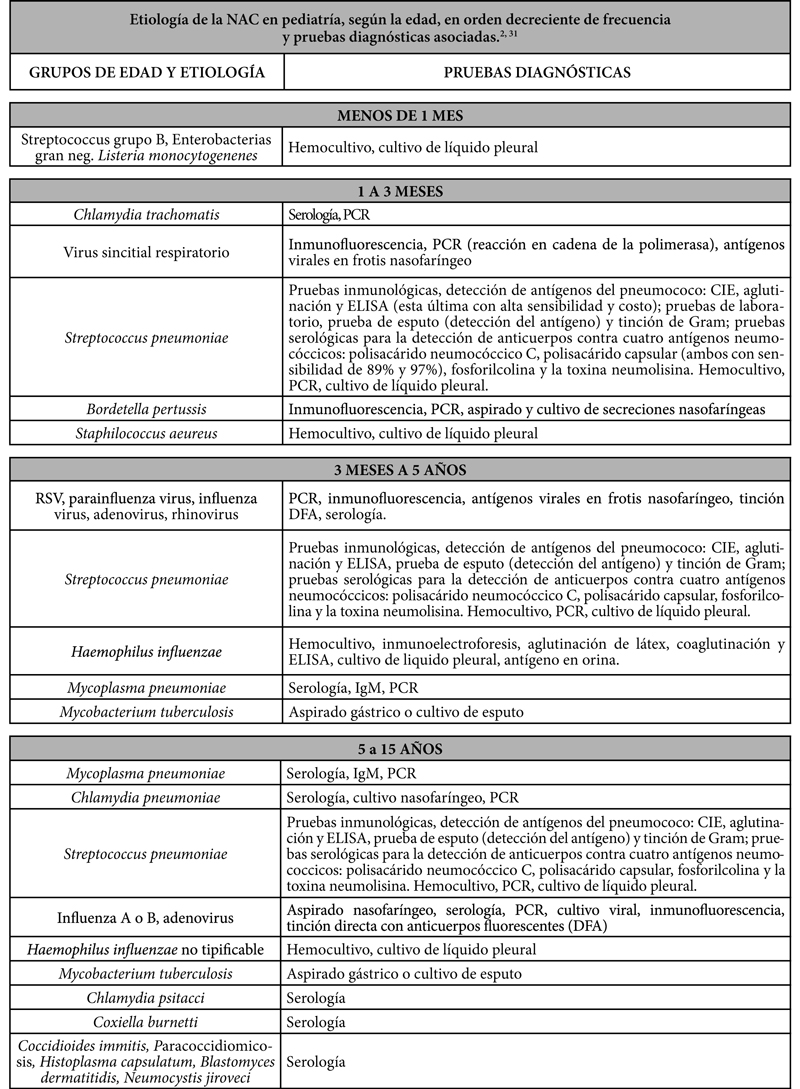
[su_spacer size=”30″]
Etiología de acuerdo a la edad
En la población pediátrica, los virus (sincitial respiratorio, adenovirus, influenza y parainfluenza) son causantes de hasta el 80 % de las neumonías en menores de 2 años. El Haemophilus influenzae es más frecuente en menores de 2 años y Mycoplasma pneumoniae y Chlamydia pneumoniae en mayores de 5 años. No obstante, a pesar del uso de técnicas exhaustivas de laboratorio, debido a la baja sensibilidad y especificidad de algunas de ellas, sólo se consigue identificar el germen causal de la infección respiratoria baja en 30-40% de los casos y suele ser difícil distinguir, por la clínica, el origen etiológico.5, 9
Causas virales poco frecuentes de NAC en pediatría
Virus: Los virus de la varicela zoster, coronavirus, enterovirus (Coxsackie y virus ECHO), citomegalovirus, virus de Epstein-Barr, herpes simple virus (en RN), poliomavirus, virus del sarampión, hantavirus.
El 33,5% de los pacientes que inicialmente presentan una neumonía viral se infecta secundariamente con bacterias. Para todas las edades el Streptococcus pneumoniae es la bacteria más frecuentemente implicada.
Clasificación
Las neumonías adquiridas en la comunidad (NAC) se pueden clasificar considerando diversos aspectos: microbiológicos, radiológicos y, fundamentalmente, los clínicos.4
Las técnicas microbiológicas permiten identificar y caracterizar el agente etiológico de la NAC. Sin embargo, debido a la escasa sensibilidad de los estudios microbiológicos, el aislamiento de un microorganismo patógeno se consigue en el 40% de los casos.
Estas pruebas se realizan en aquellas situaciones en las que es importante identificar el agente causal, tales como en los niños que requieren ingreso hospitalario o en aquellos que presenten alguna complicación o deterioro en su evolución clínica, pacientes inmunodeprimidos o bajo tratamiento inmunosupresor.8
La radiografía de tórax es la prueba radiológica para establecer el diagnóstico de neumonía. Debe realizarse con estándares técnicos adecuados y de buena calidad. No hay datos radiológicos específicos que permitan establecer una etiología concreta.
Existen dos patrones radiológicos principales de neumonía: alveolar e intersticial y, aunque clásicamente cada uno se ha relacionado con un tipo de infección, bacteriana por un lado y viral o por gérmenes atípicos (M. pneumoniae, C. pneumoniae) por otro, ninguno es exclusivo de una etiología concreta.10
En la actualidad, las neumonías se clasifican como síndromes específicos empleando diversas variables (Tabla 1, 2 y 3).
[su_spacer size=”30″]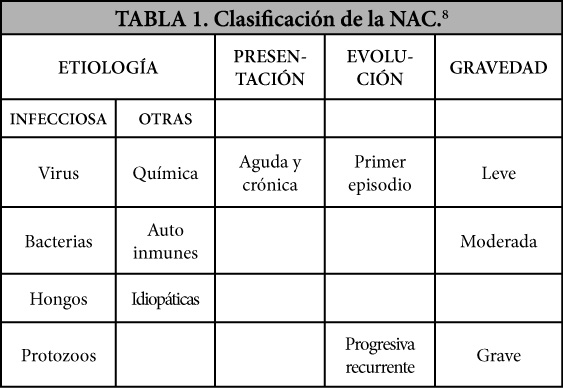 [su_spacer size=”30″]
[su_spacer size=”30″]
[su_spacer size=”30″]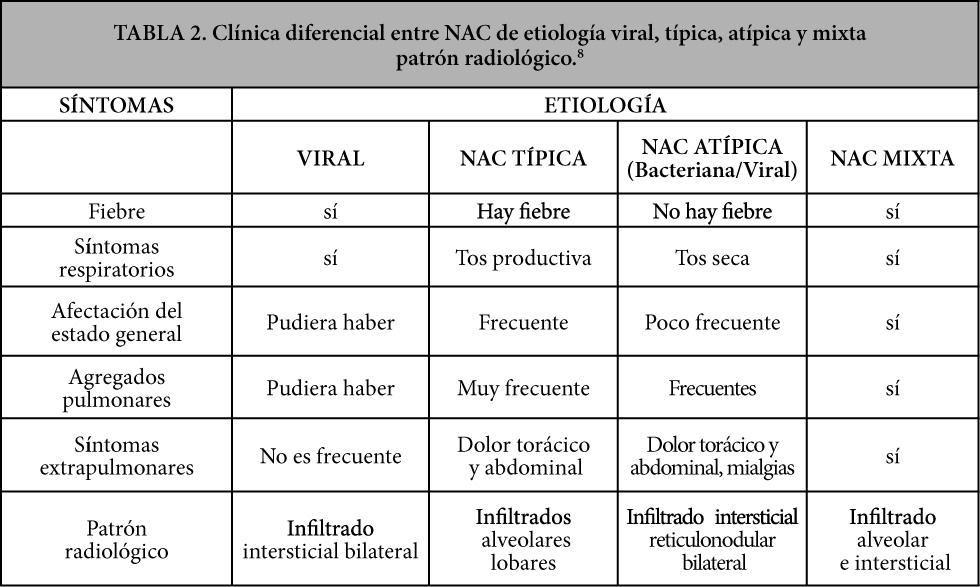 [su_spacer size=”30″]
[su_spacer size=”30″]
[su_spacer size=”30″]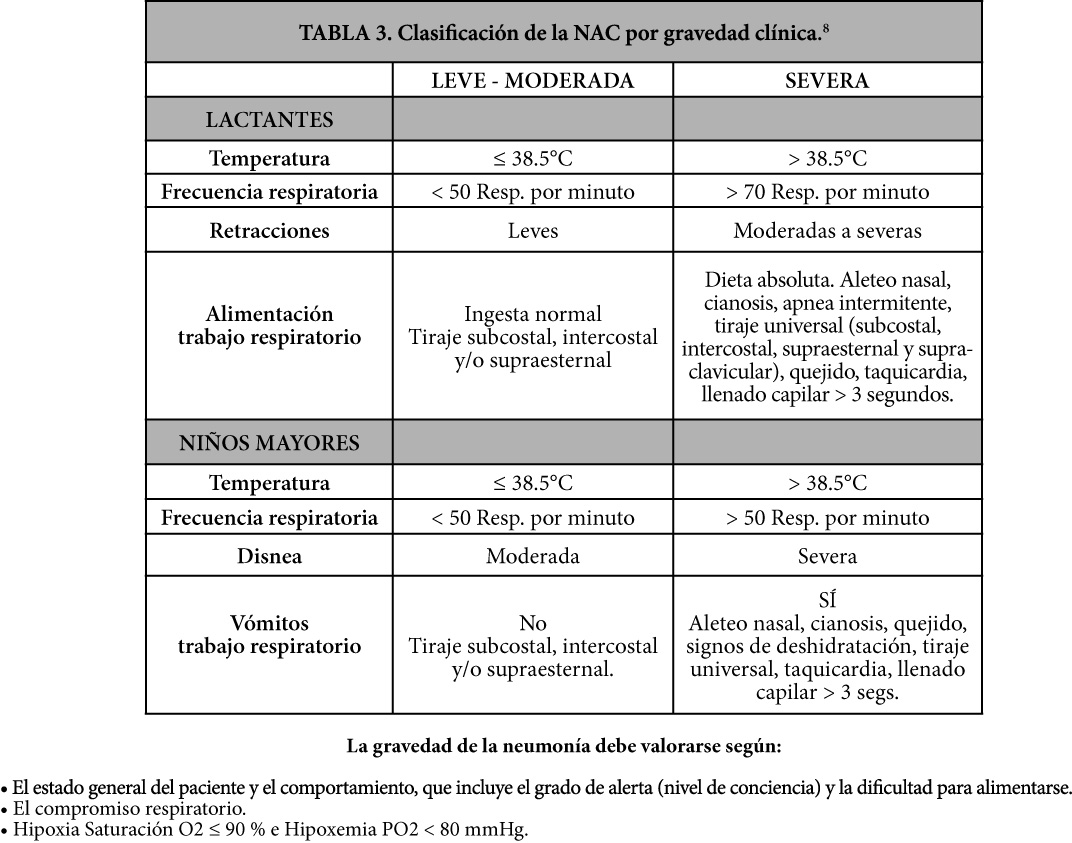 [su_spacer size=”30″]
[su_spacer size=”30″]
Clásicamente se han descrito dos formas clínicas de neumonía (típica y atípica) cuyas características (tabla 2) orientan hacia una u otra etiología, pero no son patognomónicas.
Métodos diagnósticos
Laboratorio clínico (HEMOGRAMA)
Es realizado para identificar el agente causal. Un cuadro hemático completo con recuento diferencial de leucocitos debe ser incluido en la evaluación de los pacientes con clínica de infección respiratoria baja. Las neumonías bacterianas típicas suelen presentar leucocitosis (>15.000/mm3) con predominio de polimorfonucleares, sin embargo estos hallazgos no son específicos y pueden aparecer también en las neumonías virales y faltar en algunas neumonías bacterianas.12 El valor del número de neutrófilos como marcador de infección bacteriana tiene una especificidad discreta y sólo valores muy elevados permitirían una cierta predicción, mientras que las atípicas y las virales suelen cursar por lo general con conteos leucocitarios normales y linfocitosis. En ocasiones pueden presentar leucocitosis con linfocitosis o monocitosis.
La leucopenia puede ser observada en infecciones virales, sin embargo en presencia de infección bacteriana sugiere severidad.13 La presencia de anemia hemolítica asociada puede ser sugestiva de infección por Staphylococcus aureus y Mycoplasma pneumoniae.13
Biomarcadores
El recuento de leucocitos, la velocidad de sedimentación (VSG), la proteína C reactiva (PCR), las interleucinas (IL) y la procalcitonina (PCT) son de utilidad limitada, pero su correcto empleo podría ser de ayuda para una aproximación diagnóstica.
Velocidad de sedimentación globular (VSG)
Es un mal marcador de infección aguda por lo lento de su ascenso y por su escasa sensibilidad y especificidad para diferenciar entre etiología bacteriana y viral. Solo VSG > 100 tiene utilidad como marcador de infección bacteriana. Su lenta elevación y descenso invalidan este parámetro como reactante de fase aguda con poder discriminatorio.14
Proteína Creactiva (PCR)
Aunque está elevada en un gran número de procesos inflamatorios e infecciosos, su utilidad para el diagnóstico etiológico de la neumonía adquirida en la comunidad es limitada. Una PCR superior a 60 mg/l es muy indicativa de etiología bacteriana con sensibilidad de 88%, y especificidad del 44%.14
Procalcitonina (PCT)
Distintos estudios realizados en niños evidenciaron que la elevación de la procalcitonina se relaciona con etiología bacteriana de la Neumonía adquirida en la comunidad.15
En un estudio publicado en España, valores de Procalcitonina iguales a 2 ng/ml, tuvieron una especificidad del 80% como predíctora de NAC de etiología bacteriana. Mientras que niveles inferiores a 0,5 ng/ml orientaban hacia una neumonía de etiología no bacteriana.16 Y pacientes con valores de 0,5 – 2 ng/ml indicaron posible presencia de infección bacteriana localizada.15
Se ha evaluado la utilidad de la PCT para valorar la gravedad de la Neumonía adquirida en la comunidad en niños, confirmándose que, a mayor elevación de la PCT, mayor gravedad de la NAC.17, 32
Diagnóstico microbiológico
Hemocultivo
Tiene una sensibilidad muy baja < 20-30%, dado que la neumonía neumocócica no suele cursar con bacteriemia, la tasa de hemocultivos positivos es menor del 20%, por lo que su rendimiento es muy escaso.18
Detección de antígenos bacterianos
La detección de antígeno de neumococo en orina no es útil para el diagnóstico diferencial de la neumonía neumocócica en los niños debido a que el test puede ser positivo en los portadores de Streptococcus pneumoniae y en los que han recibido recientemente vacunación antineumocócica.19
La detección de antígeno neumocócico en líquido pleural tiene, en algunos estudios, una sensibilidad y una especificidad mayor del 90%.20 La detección de antígeno soluble de Legionella en orina, tiene una sensibilidad de 60 a 90% y especificidad elevada a 99%, y está indicada en brotes epidémicos o en neumonías graves.2
Detección de antígenos virales respiratorios
El enzimoinmunoanálisis (EIA) es la base de los tests rápidos de gripe y de virus respiratorio sincitial (VRS), con una sensibilidad entre 60 y 80%, y una especificidad > 90%, con resultado muy rápido y rendimiento máximo durante el pico epidémico de la enfermedad.20
Técnicas moleculares de diagnóstico rápido
Incrementan significativamente la sensibilidad del diagnóstico microbiológico en muestras de sangre o líquido pleural21, diferenciando en el caso de Streptococcus pneumoniae los distintos serotipos implicados en el desarrollo de la enfermedad.22
Las técnicas moleculares han permitido también revaluar el papel de los virus respiratorios como agentes causales de NAC en el niño. Destacan por su sencillez y versatilidad las pruebas de PCR multiplex o las basadas en microchips arrays, que pueden llegar a identificar más de 10 patógenos virales en pocas horas.22
Líquido pleural
El cultivo del líquido pleural es con frecuencia negativo ya que cuando se obtiene la muestra, el paciente suele haber recibido tratamiento antibiótico previo. Su rendimiento es superior en caso de empiema.
Métodos serológicos
Su mayor utilidad se da en los estudios seroepidemiológicos. En el caso de las infecciones por bacterias atípicas, el diagnóstico serológico sigue siendo fundamental. La presencia de IgM especifica antimycoplasma indica una infección reciente o en curso, aparece durante la primera semana de la infección y puede persistir elevada durante meses o años.
En la reinfección no hay respuesta de IgM, sino una rápida elevación de IgG.23 En el caso de las dos especies del nuevo género Chlamydophila, compuesto por C. pneumoniae y C. psittaci, la microinmunofluorescencia es la única técnica recomendada en la actualidad para su diagnóstico sistemático.24
El primer problema clínico clave es diagnosticar NAC en los niños y luego determinar qué patógeno es responsable. El mejor predictor disponible es la edad, como orientador de posible factor etiológico de neumonía.26
Las pruebas específicas de diagnóstico etiológico se reservan sólo para aquellas situaciones en las que es importante identificar el agente causal, como en pacientes hospitalizados con neumonía moderada-grave, que cursen con agravamiento progresivo, niños inmunodeprimidos o sometidos a tratamientos inmunosupresores y brotes epidémicos, en domicilios o instituciones.27, 28
No existen hallazgos clínicos, radiológicos o de laboratorio con suficiente sensibilidad y especificidad para diferenciar la neumonía viral, bacteriana neumocócica o atípica, excepto en los estudios microbiológicos específicos en donde se aísla el microorganismo patógeno causal del proceso infeccioso pulmonar.28
Otras técnicas
En casos de pacientes con infecciones pulmonares graves y evolución clínica no satisfactoria, que incluso ameriten asistencia en la unidad de cuidados intensivos, y/o que presentan anomalías radiológicas persistentes o neumonías recurrentes lobar o multilobar, el aislamiento etiológico en la enfermedad pulmonar neumónica juega un papel importante. También el estado inmunológico del paciente está relacionado con su evolución o deterioro clínico respiratorio. Podrá ser pertinente solicitar VIH y serología para gérmenes oportunistas.
En pacientes inmunocompetentes, inmunodeprimidos donde no hay una respuesta adecuada al tratamiento inicial, es preciso tratar de averiguar cuál es el agente causal mediante la obtención de secreciones traqueobronquiales mediante lavado broncoalveolar (LBA) y fibrobroncoscopia (FB).29 El rendimiento clínico de estas técnicas y su contribución al diagnóstico son mayores en pacientes inmunodeprimidos (80%) que en pacientes inmunocompetentes.30
Tanto la fibrobroncoscopia como el lavado broncoalveolar son técnicas seguras, aunque invasivas, que pueden ser aplicadas a niños de cualquier edad o condición. Las complicaciones son mínimas y pasajeras (desaturaciones, crisis de tos, ascensos febriles). Para minimizarlas es importante la selección apropiada de los pacientes, la ejecución de la técnica por una persona experimentada que pueda realizarla con rapidez y una monitorización y oxigenación adecuada del paciente.29 La realización de toracocentesis en niños con derrame pleural permitirá obtener material para cultivo y realización de PCR.30
Diagnóstico por imágenes
En la actualidad se dispone de diversas técnicas de diagnóstico por imágenes para el estudio del tórax. La radiografía de tórax debe ser siempre el examen inicial en sospecha clínica de neumonía. Su indicación está justificada para confirmación de esta, ante dudas de diagnóstico, episodios previos de neumonías y prolongación del cuadro con escasa respuesta al tratamiento, gravedad de la neumonía o sospecha de complicaciones; de existir este último, es de utilidad la ultrasonografía (US) torácica o tomografía computarizada (TC) de tórax. La ultrasonografía permite una excelente valoración de los derrames pleurales y también puede aportar información del estado del parénquima pulmonar, pleura, pared torácica, diafragma y mediastino, es de gran utilidad en casos de neumonía necrotizante.10
Es igualmente útil para diferenciar un pequeño derrame pleural de una lesión pleural sólida o de una atelectasia. La tomografía es una excelente herramienta en la evaluación del parénquima y permite demostrar las alteraciones pulmonares en prácticamente la totalidad de los pacientes con síntomas progresivos o persistentes, su uso es limitado por la dosis de radiación que involucra y la necesidad de administrar contraste endovenoso para el análisis del compromiso pleuropulmonar.2,10 La ultrasonografía en comparación con la tomografía de tórax, evidencia mejor las loculaciones y tabiques en casos de empiemas pleurales, hallazgos que son relevantes para decidir conductas terapéuticas agresivas e intervencionistas.10
El estudio de ultrasonografía de tórax posee una sensibilidad del 100% y una especificidad del 99,7% para detectar derrame pleural, permitiendo evidenciar liquido en pleura de hasta 5 cm3.33 Mientras que, la radiografía de tórax en decúbito lateral con rayos horizontales, permite ver líquido a partir de 50 cm3.34 Caso contrario ocurre en la radiografía de tórax postero-anterior donde para detectar derrame pleural se requiere de la presencia de mínimo 150 cm3 de liquido en pleura.10
La radiografía de tórax con proyección posteroanterior suele ser suficiente para confirmar el diagnóstico de neumonía y no es recomendable el control radiológico antes de las 3 a 4 semanas para valorar la evolución de una neumonía no complicada a menos que el paciente lo requiera antes por presentar deterioro clínico o evolución clínica no satisfactoria.12, 25
Existen dos patrones radiológicos principales de neumonía: alveolar e intersticial, el primero se ha relacionado con infección bacteriana, y el segundo, con infección viral o por gérmenes atípicos, aunque el patrón radiológico no es patognomónico del agente etiológico implicado.2
El patrón alveolar se caracteriza por consolidación lobar o segmentaria con o sin broncograma aéreo o alveolograma en la imagen. El derrame pleural (DP) casi siempre se asocia a neumonía bacteriana.10, 12
Los gérmenes típicos asociados a NAC bacteriana, relacionados con este patrón radiológico son el Haemophilus influenzae, Streptococcus pneumoniae y Staphylococcus aureus. Estos dos últimos gérmenes están principalmente asociados a NAC complicada con derrame pleural. La etiología bacteriana de las NAC está sujeta, entre otros, a cambios provocados por la presión inmunitaria vacunal. La aparición de la vacuna neumocócica conjugada heptavalente (PCV7) ha disminuido su presencia.12
El patrón intersticial se caracteriza por infiltrados parahiliares bilaterales, difusos e irregulares, atrapamiento aéreo y/o atelectasias segmentarias o subsegmentarias, tapones mucosos y engrosamiento peribronquial. Y se puede observar en neumonías virales y no virales, por gérmenes atípicos como las provocadas por M. pneumoniae, C. pneumoniae y Legionella.10,12
La presentación radiográfica mixta, combina características del patrón intersticial y alveolar.10 Cuando el cuadro clínico progresa, adicional al compromiso intersticial es posible que los espacios aéreos se rellenen con fibrina, detritus celulares o hemorragia, lo que radiológicamente se verá representado por imágenes reticulares o retículo-nodulares asociadas a opacidades parcheadas, confluentes, con aspecto de consolidación unilateral o bilateral.10, 26 El criterio radiográfico para neumonía bacteriana tiene un valor predictivo positivo del 30% y un valor predictivo negativo del 92%.10,12, 26
Según los signos y síntomas clínicos, es difícil diferenciar entre neumonía bacteriana y viral, o entre neumonía típica y atípica. Esta diferenciación, que puede ser relativamente fácil en niños mayores y adolescentes, es más difícil en lactantes y niños preescolares.7 En niños, el compromiso alveolar en el estudio radiológico de tórax, en algunos casos puede adquirir una forma redondeada, densa, semejante a una masa, lo que se conoce como neumonía redonda, habitualmente de etiología neumocóccica.10 Si bien la presencia de síntomas como tos, decaimiento y fiebre, apoyan en forma obvia el diagnóstico de neumonía, frente al aspecto radiológico de imagen redondeada es necesario hacer el diagnóstico diferencial de estas lesiones con lesiones neoplásicas pulmonares, aunque son muy raras en la edad pediátrica. Algunos tumores pueden presentarse como masas redondeadas y constituir diagnóstico diferencial de una neumonía redonda.
[su_spacer size=”30″]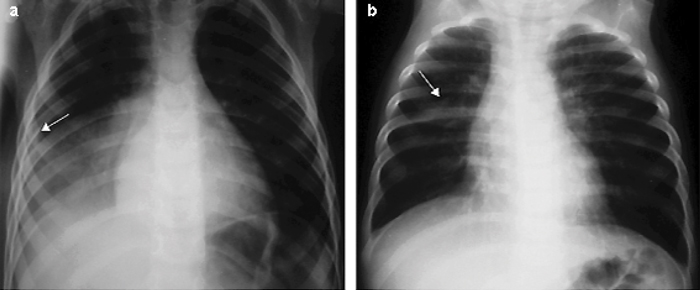 Rx de tórax AP de NAC con patrón bacteriano (A) y patrón viral (B). A) Condensación basal derecha que borra hemidiafragma ipsilateral (signo de la silueta) preservando la línea paracardial, compatible con foco único de neumonía con patrón bacteriano en LID. Mínimo derrame pleural acompañante (flecha). B) Engrosamiento peribronquial bilateral en localización parahiliar junto a atelectasia segmentaria en LSD (flecha), con elevación de la cisura menor. Discreto atrapamiento aéreo bilateral (9 y 10 espacios intercostales derecho e izquierdo, respectivamente).
Rx de tórax AP de NAC con patrón bacteriano (A) y patrón viral (B). A) Condensación basal derecha que borra hemidiafragma ipsilateral (signo de la silueta) preservando la línea paracardial, compatible con foco único de neumonía con patrón bacteriano en LID. Mínimo derrame pleural acompañante (flecha). B) Engrosamiento peribronquial bilateral en localización parahiliar junto a atelectasia segmentaria en LSD (flecha), con elevación de la cisura menor. Discreto atrapamiento aéreo bilateral (9 y 10 espacios intercostales derecho e izquierdo, respectivamente).
[su_spacer size=”30″]
De acuerdo a esto considerar estudios radiológicos en proyección lateral o más específicos como tomografía de tórax, según impresión diagnóstica y clínica del paciente.10,12,21,25 La neumonía redonda puede ser también multifocal, lo que obliga a considerar el diagnóstico diferencial de nódulos pulmonares múltiples.12 Es la edad del niño el parámetro que más se correlaciona con el agente causal. Así, en niños mayores de 5 años la probabilidad de neumonía bacteriana es 20 veces mayor que la neumonía viral.
La radiografía de tórax no tiene suficiente sensibilidad para establecer la etiología causal de la neumonía, ya que no puede diferenciar con exactitud el patógeno implicado, sin embargo, existen patrones radiológicos que se observan más frecuentemente en infecciones pulmonares bacterianas y otros en infecciones pulmonares virales4.
Bibliografía
- Reyes M. Aristizabal G. Leal F. Neumonología Pediátrica.Infección, Alergia y Enfermedad Respiratoria en el Niño. 5ta ed. Bogotá Colombia: Médica Panamericana; 2006.
- Bradley JS, Byington CL, Shah SS, et al. The management of community acquired pneumonia in infants and children older than 3 months of age: clinical practice guidelines by the Pediatric Infectious Diseases Society and the Infectious Diseases Society of America. Clin Infect Dis 2011; 53(7): e25–76.
- World Health Organization. The management of acute respiratory infections in children. Practical guidelines for out patients care. Geneve: WHO 1995.
- Sociedad Española de Infectología Pediátrica. Infectología Pediátrica Básica: Manejo práctico. ed. Médica Panamericana; 2012.
- Ucros S. Guía de Pediatría Práctica basadas en la Evidencia. 2da ed. Bogotá: Médica Panamericana; 2009.
- Burroughs M, Horga MA, Murrell MT, Moscona A. Respiratory infections. En: S, Gershon AA, Hotez PJ, Kataz SL, eds. Krugman´s Infectious Disease of Children. 12ª edición. Philadelphia: Mosby; 2008.
- Korppi M, Don M, Valent F, Canciani M. The value of clinical features in differentiating between viral, pneumococcal and atypical bacterial pneumonia in children. Acta Paediatr. 2008; 97: 943-947.
- Harris M, Clark J, Coote N,et al. British Thoracic Society Guidelines for the Management of Community Acquired Pneumonia in Children: 2011.
- Levine OS, O’Brien KL, Deloria-Knoll M, et al. The pneumonia etiology research for child health project: a 21st century childhood pneumonia etiology study. Clin Infect Dis 2012; 54 (Suppl 2):S93–101.
- Moënne K, Ortega X. Neumonía adquirida en la comunidad, Cap. 6 en Diagnóstico por imágenes del tórax pediátrico. Buenos Aires, Journal 2012. 93-111.
- Balfour-Lynn IM, Abrahamson E, Cohen G, Hartley J, King S, Parikh D, et al. BTS guidelines for the management of pleural infection in children. Thorax. 2005; 60 Suppl 1:1-21.
- Del Cura J. Pedraza S. Radiología Esencial. Buenos Aires Argentina: Médica Panamericana; 2010.
- Del Castillo M, Duque M, Madero R, García M, De José Gómez MI, Baquero F, et al. Proteina C reactiva y procalcitonina en la neumonía por neumococo adquirida en la comunidad. Pediatría Integral. 2008; 12: 909-912.
- Summah H, Qu JM. Biomarkers: A definite plus in pneumonia. Mediators Inflammatory; 2009.
- Don M, Valent F, Korppi M, Canciani M. Differentiation of bacterial and viral community-acquired pneumonia in children.Pediatr Int. 2009; 51: 91-6
- García-Zarza Martínea E, Ramos Amador JT, Rubio Gribble B, Corrales del Rio E, Zeballos Sarrato G, Herrera Montes J.Utilidad de la procalcitonina sérica en la orientación etiológica de los niños con neumonía adquirida en la comunidad. AnPediatr (Barc). 2004; 60: 279-81.
- Nascimento-Carvalho CM, Cardoso MR, Barral A, Araújo Neto CA, Guerin S, Saukkoriipi A, et al. Procalcitonin is useful in identifying bacteraemia among children with pneumonia. Scand J Infect Dis. 2010; 42: 644-649.
- García Miguel MJ, Méndez E. Neumonía aguda: Pediatría Extrahospitalaria.4ta ed. Madrid: Ergo; 2008. p299-302.
- Fletcher M, Leeming J, Cartwright K, Finn A, Group SWoEICAIS. Childhood empyema: limited potential impact of 7-valent pneumococcal conjugate vaccine. Ped Inf Dis J. 2006; 25: 559-561.
- Rovida F, Percivalle E, Zavattoni M, Torsellini M, Sarasini A, Campanini G, et al. Monoclonal antibodies versus reverse transcription-PCR for detection of respiratory viruses in a patient population with respiratory tract infections admitted to hospital. J Med Virol. 2005; 75: 336-347.
- Johansson N, Kalin M, Tiveljung-Lindell A, Giske CG, Hedlund J. Etiology of community-acquired pneumonia: increased microbiological yield with new diagnostic methods. Clin Infect Dis. 2010; 50: 202-209.
- Gadsby NJ, Hardie A, Claas EC, Templeton KE. Comparison of the luminex respiratory virus panel fast assay with in-house real-time PCR for respiratory viral infection diagnosis. J Clin Microbiol. 2010 ;48: 2213-2216.
- Waites kb, Robertson J.A., Talkington DF, Kenny G. Laboratory diagnosis of mycoplasmatal infections. Cumitech 35 ed; Washington: ASM Press, 2007.
- Strålin K. Usefulness of aetiological tests for guiding antibiotic therapy in community-acquired pneumonia. Int J Antimicrob Agents. 2008; 31:3-11.
- Ketai Loren, Richard L, Meholic A. Principios de Radiología Toracica.2da ed.Buenos aires: Médica Panamericana; 2007.
- Padín Martín MI. Viral infections. En: Martínez-León MI,Ceres-Ruiz L, Gutiérrez JE, editors. Learning pediatric imaging,8. Heldelberg: Ed. Springer; 2011. p.80-100.
- Don M, Canciani M, Korppi M. Community-acquired pneumonia in children: what’s old? What’s new? Acta Paediatr. 2010; 99: 1602-1608.
- García Miguel MJ, Méndez Echevarría A. Neumonía aguda. En: Muñoz Calvo MT, Hidalgo Vicario MI, Clemente Pollán J,eds. Pediatría Extrahospitalaria. 4ª edición.Madrid: Ergon; 2008. p. 299-302.
- Escribano Montaner A, Caro Aguilera P. neumonía adquirida en la comunidad. En: Andrés A, Valverde J, editores. Manual de neumología infantil. Madrid: Ed.Panamericana; 2010. p. 215-227.
- Méndez A, García MJ, Baquero F, Del Castillo F. neumonía Adquirida en la Comunidad. Protocolos actualizados. Infectología Pediátrica. 2008. Madrid: Asociación Española de Pediatría; 2008. p. 57-63.
- Pui-Ying Iroh T.Approach to Common Bacterial Infections: Community-Acquired Pneumonia. Pediatr Clin N Am: Elsevier; 2013.
- Don M, Valent F, Korppi M, Falleti E, De Candia A, Fasoli L,et al. Efficacy of serum procalcitonin in evaluating severity of community-acquired pneumonia in childhood. Scand J Infect Dis. 2007; 39: 129-37.
- Kocijancic I, Vidmar K, Ivanovi-Herceg Z. Chest sonography versus lateral decubitus radiography in the diagnosis of small pleural effusions. J Clin Ultrasound 2003; 31: 69-74.
- Knisley B L. Diseases of the Pleura. En; Juhl J H, Crummy A B, Kulman J E, editors. Paul and Juhls. Essentials of Radiologic Imagin. 7 ed. Philadelphia:Lippincott-Raven Publishers; 1998: 1141-69
Autores
Dra. Karen Moreno Cedeño
- Dra. Karen Moreno Cedeño#molongui-disabled-link
- Dra. Karen Moreno Cedeño#molongui-disabled-link

