Recomendaciones de la Sociedad Española de Nefrología para el manejo de las alteraciones del metabolismo óseo-mineral en los pacientes con enfermedad renal crónica
Resumen
Al igual a como ocurrió en el año 2011, cuando la Sociedad Española de Nefrología (SEN) publicó la adaptación española a las guías universales Kidney Disease Initiative Global Outcomes (KDIGO) sobre alteraciones del metabolismo óseo-mineral en la enfermedad renal crónica (CKD-MBD), este documento contiene una actualización y adaptación a nuestro medio de las guías KDIGO del 2017. En este campo, al igual que en muchos otros nefrológicos, no se ha podido contestar irrefutablemente muchas cuestiones pendientes aún. Sin embargo, no hay duda acerca de la estrecha relación entre el complejo CKD-MBD/patología cardiovascular/morbimortalidad, nuevos ensayos clínicos aleatorizados en algunas áreas o la aparición de nuevos fármacos han proporcionado notables avances en este campo y crearon la necesidad de dicha actualización. Así, destacamos las discretas divergencias que ofrecemos en los objetivos ideales de las alteraciones bioquímicas del complejo CKD-MBD respecto a las sugerencias de las KDIGO (en relación, por ejemplo, con la hormona paratiroidea o fosfato), el papel de la vitamina D nativa y análogos en el control del hiperparatiroidismo secundario, así como la contribución de nuevos captores de fosfato y calcimiméticos. Asimismo, es de destacar la adopción de importantes novedades en el diagnóstico de las alteraciones óseas del paciente renal y la necesidad de tomar actitudes más proactivas en su tratamiento. En cualquier caso, la velocidad a la que acaecen novedades actualmente, aunque menor de la que sería deseable, sí impulsan globalmente la necesidad de actualizaciones con menor demora (por ejemplo, a través de Nefrología al día).
Palabras clave:
Guías, CKD-MBD, PTH, Hiperparatiroidismo, Fosfato, Fósforo, Osteoporosis
Evaluación del problema del metabolismo óseo-mineral
Definiciones
Osteodistrofia renal ha sido un término empleado tradicionalmente para referirse a las alteraciones del metabolismo óseo-mineral de los pacientes con enfermedad renal crónica (ERC). La fundación Kidney Disease: Improving Global Outcomes (KDIGO) propuso nuevas definiciones y un sistema de clasificación más integrado, relegando el término tradicional de osteodistrofia renal1–5.
- Osteodistrofia renal (ODR): este término queda restringido a las alteraciones de la morfología y arquitectura ósea propias de la ERC (figs. 1 y 2). El diagnóstico de confirmación es la biopsia ósea.
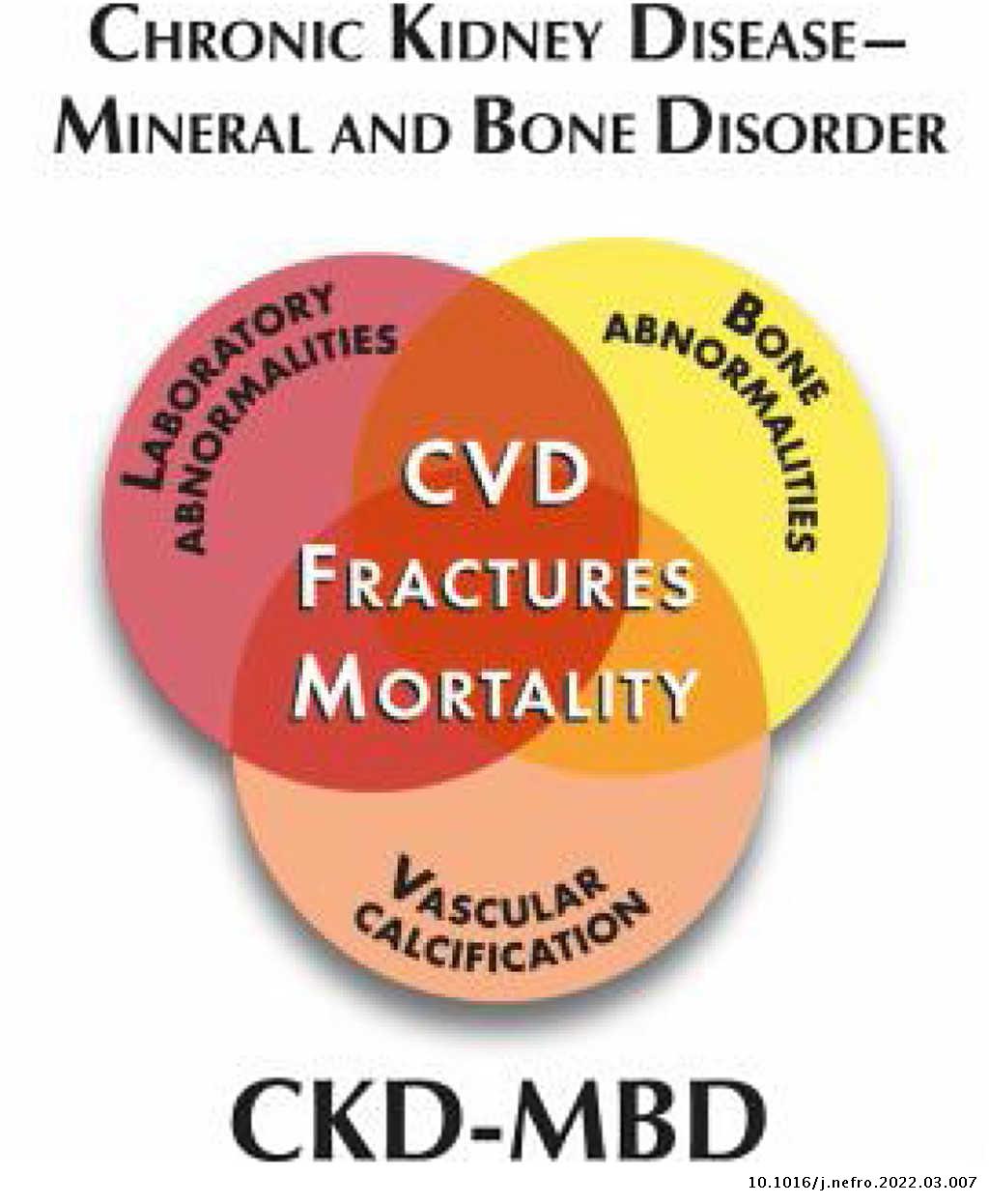
- Alteración óseo-mineral asociada a la ERC: este término en inglés Chronic Kidney Disease-Mineral Bone Disorder (CKD-MBD) integra todas las alteraciones bioquímicas, esqueléticas y calcificaciones extraesqueléticas que ocurren como consecuencia de las perturbaciones del metabolismo mineral en la ERC como una entidad sistémica (fig. 3) y que se asocia a un aumento de mortalidad. Se manifiesta por una, o por la combinación de las siguientes manifestaciones:
- Anormalidades del calcio (Ca), fósforo (P), hormona paratiroidea (PTH) y vitamina D.
- Alteraciones en el remodelado, mineralización, volumen, crecimiento o fragilidad del esqueleto.
- Calcificaciones cardiovasculares o de otros tejidos blandos.
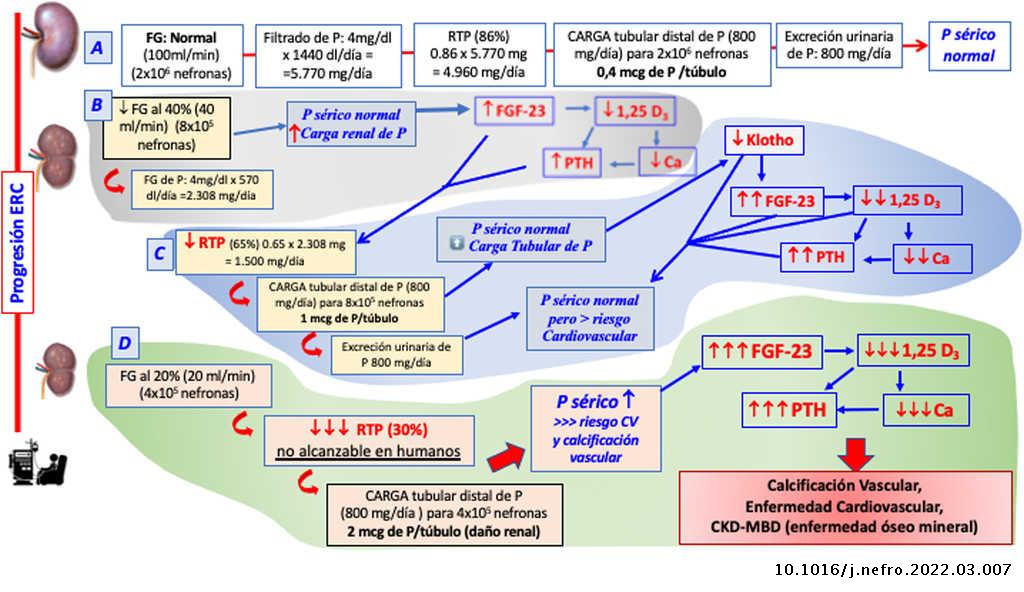
Fisiopatología (fig. 4)
Lasdiferentes alteraciones metabólicas son secundarias a la pérdida progresiva de masa y/o función renal (capacidad depurativa). El riñón es esencial en la homeostasis mineral por ser fuente de alguna de sus moléculas reguladoras (klotho, calcitriol) y al mismo tiempo órgano diana, siendo el principal regulador del balance del fosfato del organismo. Esto justifica que el deterioro progresivo de la homeostasis fosfocálcica y su regulación endocrina se inicie en los primeros estadios de la ERC.
Es conocido que descensos moderados del aclaramiento de creatinina (inferior a 70 mL/min aproximadamente) pueden provocar un aumento de la fosfatemia tras una sobrecarga de fósforo, junto con una potencial disminución transitoria de la calcemia, que pueden objetivarse de forma puntual y precoz6. Sin embargo, a pesar de la retención precoz de fosfato, el incremento de sus valores séricos no se suele detectar hasta los estadios 4 y 5 de ERC, cuando se sobrepasan los mecanismos fosfatúricos compensadores derivados de la acción del fibroblast growth factor 23 (FGF23) y de la hormona paratiroidea (PTH) que no pueden incrementar la fracción excretada de fósforo (FEP) por encima de 50%. Por eso, la fosfatemia es un marcador poco sensible, más aún si añadimos que el fosfato circulante representa solo un 1% aproximadamente de su contenido total en el organismo. Alternativamente, el aumento precoz de FGF23 en plasma o la evaluación del esfuerzo fosfatúrico (medido como aumento de la fracción excretada de fosfato urinario o transporte máximo de fosfato por filtrado glomerular o simplemente fosfaturia dividida por filtrado) podrían ser buenos indicadores de retención de fosfato antes del aumento de sus valores séricos. En los estadios tempranos de la enfermedad renal no se ha evaluado si para medir el esfuerzo fosfatúrico, la excreción urinaria de P relativa al filtrado es más fiable o menos que el FGF237.
El FGF23 se incrementa precozmente en la ERC. Su síntesis, fundamentalmente ósea, depende de la interacción entre factores locales, que modulan el remodelado óseo y la mineralización, y factores sistémicos relacionados con la homeóstasis mineral. Entre estos últimos, sus principales estímulos son la retención de fosfato, la vitamina D y la PTH. Su control sobre la homeostasis del fosfato se ejerce mediante una acción fosfatúrica para liberarse del exceso de fosfato y mediante la acción inhibidora de la síntesis de vitamina D para impedir el aumento de fósforo procedente de intestino y hueso.
También de forma precoz se observa en pacientes con ERC un descenso discreto, pero significativo, del calcitriol (1,25(OH)2D3) secundario a:
- Una disminución en la disponibilidad de sustrato [calcidiol (25(OH)D3)] para la síntesis renal de calcitriol. El calcidiol sufre un proceso de filtración glomerular para penetrar en la célula tubular con la intervención de la megalina (un receptor endocítico situado en la membrana apical) e hidroxilarse (en la posición 1-alfa) a calcitriol. La reducción del filtrado glomerular limita el acceso de calcidiol a la célula tubular, situación que se ve agravada si coexiste con una deficiencia nutricional de vitamina D (muy prevalente incluso en la población general) por falta de exposición solar y/o ingesta inadecuada. En fases más avanzadas de la ERC, la disminución de megalina (que está sobrerregulada por el propio calcitriol), contribuye también a esta menor disponibilidad de calcidiol.
- La acción inhibidora del FGF23 sobre la 1 alfa-hidroxilasa (o CYP27B1), disminuyendo la síntesis renal de calcitriol, al mismo tiempo que promueve su catabolismo por la inducción de la 24-hidroxilasa (o CYP24A1).
- La pérdida de masa renal, que ocasiona una menor disponibilidad de 1-alfa-hidroxilasa.
Esta disminución de los niveles de calcitriol se ve en parte contrabalanceada por el efecto estimulador de la PTH sobre la síntesis de calcitriol (1 alfa-hidroxilasa).
Los valores de calcitriol circulante (generalmente no usados en clínica), que ejerce las funciones calciotrópicas a través de la activación endocrina del receptor de la vitamina D (RVD), proceden esencialmente de la síntesis renal. Su descenso contribuye a una disminución en la absorción intestinal de calcio, ya en estadios 2 y 3 de ERC. Sin embargo, también se sintetiza calcitriol en otras células del organismo donde ejerce otras funciones autocrinas y paracrinas pleiotrópicas. Estas células captan el calcidiol circulante, lo hidroxilan a calcitriol, lo utilizan y lo degradan, todo ello intracelularmente. La activación autocrina del RVD, fundamental para la propia supervivencia de la célula renal y para el sistema cardiovascular, depende de factores tisulares específicos y no está regulada hormonalmente (por la PTH y el FGF23).
Por otro lado, una disminución en los niveles circulantes de calcidiol, que también se produce en la ERC, puede comprometer esta activación auto- o paracrina. Esto se debe a: (a) una disminución en su aporte solar e ingesta por restricciones dietéticas, uremia, insuficiencia biliar y pancreática, etc.; (b) un aumento de su catabolismo inducido por el FGF23 (la 24-hidroxilasa también cataboliza al 25(OH)D); y (c) una mayor dificultad para acceder al interior de estas células por la infrarregulación de receptores como la megalina u otros, que están inducidos por el propio calcitriol. Además, un estudio muestra que la capacidad del hígado de producir 25(OH)D3 está disminuida en ratas urémicas y que la paratiroidectomía mejora la capacidad del hígado de producir calcidiol8.
La retención de fosfato, junto al déficit de calcitriol y su correspondiente hipocalcemia (transitoria) condicionan el desarrollo de un hiperparatiroidismo secundario (HPTS). El incremento de los niveles de PTH se observa especialmente con filtrados glomerulares inferiores a 60 mL/min/1,73 m2. Además de estos factores, posiblemente también contribuyan moléculas producidas por el propio tejido renal enfermo, o bien la disminución, falta de afinidad o infrarregulación de receptores como la megalina u otros factores correguladores.
El klotho es una molécula que actúa como correceptor del FGFR19, klotho independientemente de FGF23, tiene actividad fosfatúrica10. En la ERC, la expresión de klotho disminuye y ello puede causar disminución de excreción de P por resistencia al FGF23 y por deprivación de una acción independiente sobre la fosfaturia. Es posible que la propia excesiva carga tubular de P sea causa de una reducción de la expresión renal de klotho9,11.
En las glándulas paratiroides existen al menos tres receptores clásicos bien conocidos a través de los que se ha demostrado se canalizan los efectos de las moléculas y hormonas que modulan tanto la síntesis y secreción de PTH como el tamaño glandular (proliferación celular, hiperplasia), y que serán de gran importancia para valorar las alternativas terapéuticas frente al HPTS y las alteraciones del complejo CKD-MBD. Recientemente se han aportado evidencias sólidas sobre la existencia de una nueva función de uno de estos receptores12.
Estos receptores son:
Receptor de vitamina D
- La acción de la vitamina D sobre la PTH es mediada por este receptor citosólico que se transloca al núcleo para ejercer su acción sobre los elementos de respuesta a la vitamina D del DNA (VDRE).
- Con la progresión de la ERC, el número de RVD decrece; el propio estado urémico puede disminuir la estabilidad del ARNm del RVD, produciendo un descenso en los niveles de proteína del receptor. Además, «toxinas urémicas» disminuyen el paso del complejo RVD-vitamina D al núcleo y su unión a los VDRE13.
- El déficit de RVD en la glándula paratiroides produce resistencia a la acción inhibitoria de la vitamina D sobre la síntesis de PTH.
- La hiperplasia de las glándulas paratiroides se acompaña de disminución en la densidad de RVD. En estados avanzados de hiperplasia («hiperplasia nodular»), la disminución de los RVD es muy marcada.
Receptor-sensor de calcio (RSCa)
- Situado en la superficie de las células paratiroideas (receptor de membrana), detecta cambios mínimos en los niveles séricos de calcio y actúa a nivel postranscripcional modulando la vida media del ARNm de PTH. Cuando el nivel de calcio sérico desciende, no hay suficiente calcio unido a estos receptores y se deja de inhibir la secreción de PTH.
- Su déficit produce resistencia a la acción inhibitoria del Ca sobre la glándula paratiroides.
- El desarrollo progresivo de hiperplasia paratiroidea secundaria a la ERC está también asociado a una disminución de los RSCa en las células paratiroideas.
- El P elevado estimula directamente la secreción y síntesis de PTH14–17. Posiblemente este efecto lo hace disminuyendo la actividad del RSCa18.
- Recientemente se ha descrito que el receptor sensor de calcio también actúa como sensor de los niveles de fósforo en la glándula paratiroides12, hallazgo que ayuda a explicar la rápida y potente respuesta de las elevaciones de fósforo sobre la paratiroides.
Receptor 1 del factor de crecimiento fibroblástico (FGF-R1) y klotho
Se ha demostrado en la paratiroides la existencia del receptor FGF-R1 y su «correceptor», la proteína klotho, que en condiciones fisiológicas permite al FGF23 ejercer una acción inhibitoria sobre la glándula paratiroides. En experimentos en medio urémico, tanto en animales como en muestras de paratiroides hiperplásicas de pacientes, se ha evidenciado una disminución del FGF-R1 y de klotho, lo que conduce a una resistencia de las paratiroides a la acción inhibitoria del FGF23.
Efecto de moléculas y hormonas sobre los receptores:
- El descenso del calcio extracelular es detectado por el RSCa en la membrana plasmática estimulando a nivel postranscripcional la producción de PTH.
- La retención de fosfato estimula la síntesis y secreción de PTH por mecanismos directos (también postranscripcionales), pero también indirectos: disminución de calcitriol, disminución de la respuesta calcémica a la PTH (resistencia a la PTH), etc. Además, induce hiperplasia de las paratiroides que a su vez disminuye la expresión del RSCa y del RVD, que subsecuentemente también favorecen la síntesis y secreción de PTH.
- La vitamina D actúa a nivel transcripcional sobre el RVD suprimiendo la síntesis y secreción de PTH. Su déficit disminuye este efecto.
- El déficit de calcitriol provoca infrarregulación de la expresión del ARNm del RVD. Igualmente, una disminución de calcio parece infrarregular la expresión del RSCa y del RVD, mientras que el aumento de calcio parece aumentar la expresión del RVD pero no del RSCa19. También se sabe que el calcitriol es capaz de sobrerregular su propio receptor en distintos tejidos19. En relación con este efecto, también se conoce que existen diferencias entre distintos análogos de la vitamina D, y asimismo, parece que los calcimiméticos podrían aumentar la expresión del RVD en la glándula paratiroides20.
- El calcitriol también puede aumentar la expresión del RSCa. Este efecto se debilita cuando existe hipocalcemia y es más marcado cuando los niveles de calcio son normales o altos, o cuando se administran calcimiméticos20.
Lesiones asociadas
Como consecuencia de estas alteraciones se producirá un daño en los tejidos diana. El esqueleto y el sistema cardiovascular son los tejidos principalmente afectados. Las calcificaciones de tejidos blandos y la calcifilaxis son también complicaciones de gran importancia pues se asocian claramente a un aumento de la morbimortalidad de los pacientes con ERC.
Las calcificaciones valvulares y vasculares no se presentan como un proceso pasivo de deposición de calcio y fósforo. Se ha observado que el incremento de los niveles de fosfato, calcio, los mediadores inflamatorios y la uremia per se, entre otros, favorecen la transformación activa de las células musculares lisas en células de estirpe condroosteogénica, que producen matriz colágena que posteriormente se mineraliza (osificación cardiovascular). Múltiples inhibidores de calcificación, tanto sistémicos (por ejemplo, fetuína A) como locales (por ejemplo, matrix gla protein) contrabalancean el efecto acelerador de la uremia sobre la calcificación vascular. De hecho, calcio y fosfato se combinan con proteínas inhibidoras de la calcificación para formar nanopartículas calciproteicas (primarias o secundarias) que intervienen en estos procesos de calcificación vascular21. La acidosis metabólica puede disminuir la progresión de las calcificaciones22 y la alcalosis (por ejemplo, posdiálisis) podría favorecerla. Las calcificaciones cardiovasculares progresan de manera acelerada en pacientes con ERC.
Otros procesos relacionados con la edad (y en la ERC existe un envejecimiento acelerado multifactorial), como el incremento de la fragilidad ósea y la incidencia de fracturas (osteoporosis senil o postmenopáusica), la debilidad muscular y propensión a las caídas, o la propia enfermedad arteriosclerótica, no pueden considerarse asociadas directamente a la ERC, pero sí coexistir o agravarse con ella. Más aún, influyen sobre el diagnóstico, tratamiento y pronóstico de los efectos de la ERC sobre sus órganos diana.
Es probable que estos efectos deletéreos sean debidos a fenómenos que trascienden las alteraciones óseas. La hiperfosfatemia se ha asociado a un aumento del grosor íntima-media, rigidez y calcificación vascular, hipertrofia miocárdica y mortalidad23,24, entre otras (inducción de inflamación, estrés oxidativo, disfunción endotelial), además de la progresión de la ERC23,24. La PTH se ha considerado clásicamente como una toxina urémica y se ha asociado a distintos efectos sistémicos5. Más recientemente, ha adquirido importancia el déficit de vitamina D, que se asocia a alteraciones de la inmunorregulación, respuesta inflamatoria, regulación de la proliferación celular, secreción de insulina o la producción de renina, entre otros25. Además, el calcidiol tiene una acción directa sobre el metabolismo óseo y es substrato local para la generación de calcitriol.
Por otra parte, el aumento de FGF23 se ha relacionado con la inducción directa de hipertrofia ventricular izquierda a través del FGF-R426, así como a la alteración en la vasodilatación dependiente de endotelio y con múltiples efectos sistémicos, incluyendo inflamación y los relacionados con el manejo de calcio y sodio27, entre otros, aunque este último ha sido cuestionado.
Como se ha mencionado, el aumento de FGF23 parece preceder a la elevación de fósforo y PTH en plasma, pero la alteración más precoz en la ERC podría ser la disminución de klotho, tanto como proteína transmembrana, provocando resistencia a la acción de FGF23 en los tejidos en que debería expresarse normalmente, como en su fracción libre circulante. Esta situación podría tener relación con acciones sistémicas implicadas en procesos de envejecimiento prematuro y, al menos en parte, serían independientes del FGF2328.
Como consecuencia de estos efectos, el hueso, concebido como nuevo órgano endocrino (a través no solo del FGF23, sino también de otras hormonas [por ejemplo, osteocalcina] o vías de señalización como la de Wnt [por ejemplo, esclerostina/Dkk1] o la de osteoprotegerina/RANKL), y las alteraciones asociadas del metabolismo mineral han demostrado en la población con ERC (principalmente en diálisis), pero también en la población general, ser predictores independientes de mortalidad, especialmente de causa cardiovascular, sobre la base de múltiples estudios epidemiológicos, metaanálisis, análisis secundarios preespecificados en ensayos clínicos prospectivos aleatorizados y estudios post hoc24,28–36.
Sin embargo, no existe prueba definitiva de causalidad, entre otras razones, porque todos los grandes estudios se han visto directa o indirectamente afectados por la falta de poder estadístico final de los mismos37,38.
Estrategias diagnósticas
El objetivo es definir los métodos diagnósticos idóneos para el estudio y manejo de las alteraciones del metabolismo mineral. Esta información resulta de la síntesis de las recomendaciones extraídas de las guías de actuación clínica, tales como las guías KDOQI, KDIGO, de la opinión de expertos obtenida de la literatura y de la propia opinión de los autores de estas recomendaciones1,2,4,39,40.
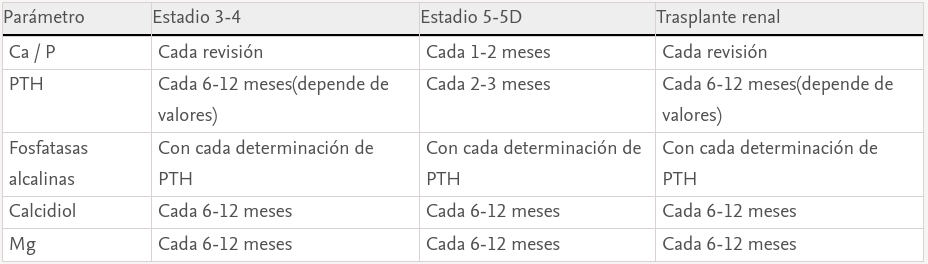
En cuanto a la periodicidad de determinaciones bioquímicas, si bien están establecidas en la Guía de calidad de la SEN41, mostramos a continuación algunas recomendaciones más específicas.
Parámetros bioquímicos (tabla 1)
Enprimer lugar, recomendamos que los laboratorios informen a los clínicos del método de medición usado y reportar cualquier cambio en la metodología, muestra de origen (suero o plasma), así como la manipulación adecuada de las muestras para facilitar una correcta interpretación de los resultados bioquímicos. En la ERC es menos importante el valor aislado de un parámetro que el cambio o tendencias observadas en ese mismo parámetro; por ello es tan importante que los métodos se mantengan y si hay que cambiar debe avisarse para realizar las correcciones oportunas. Esta recomendación es especialmente relevante para la medición de PTH, calcidiol y otras hormonas, así como para la creatinina (métodos con adecuada trazabilidad) y la albúmina (con importantes diferencias entre métodos que usan el azul o el púrpura de bromocresol)42–44.
Calcio y fosfato
La determinación periódica de valores séricos de calcio y fosfato, junto a la PTH y fosfatasa alcalina, es decisiva para el manejo terapéutico del paciente. Idealmente debe usarse el calcio iónico, pero hay problemas de procesado y costo para su uso rutinario. Usando el calcio total es recomendable ajustar para los niveles de albúmina (o proteínas plasmáticas), especialmente en caso de hipoalbuminemia o hipoproteinemia.
Ca total corregido (mg/dL) = Ca total (mg/dL) + 0.8 [4-albumina (g/dL)]
Debemos tener en cuenta no obstante que la precisión del uso de calcio corregido por albúmina y calcio ionizado es solo débil, probablemente debido a las variaciones de albúmina, pH, fenómenos de hemoconcentración, y otros, presentes en pacientes en diálisis o con ERC45,46. Incluso se han desarrollado fórmulas de corrección que tienen también en cuenta el fosfato plasmático además de la albúmina47.
Es importante también recordar que la concentración extracelular de calcio no siempre se correlaciona con el balance de calcio (que puede ser positivo o negativo con calcio plasmático normal). Lo mismo ocurre con el fosfato, de modo que un fosfato plasmático normal no excluye la presencia de retención sistémica.
Por otra parte, los valores de calcio y fosfato aislados no son suficientes para el manejo de los pacientes con ERC, ya que es muy habitual la normalidad de calcio y fosfato a expensas de la presencia de HPTS, incluso severo.
- Nos parecen razonables los intervalos de monitorización sugeridos por las KDIGO de: a) estadio 3: Ca y P cada seis a 12 meses; b) dstadio 4: Ca y P cada 3-6 meses; c) dstadio 5: Ca y P cada uno a tres meses; sin embargo, en estadio 5D, la determinación mensual/bimensual nos parece la más adecuada.
- Puede ser necesaria una mayor frecuencia en pacientes bajo tratamiento con calcimiméticos o con metabolitos activos de la vitamina D, sobre todo en periodo de ajuste de dosis.
- La extracción, en los pacientes en hemodiálisis, debería realizarse en el periodo corto, es decir, prediálisis a mitad de semana.
- El producto calcio-fósforo proporciona una información que puede ser de utilidad, pero solo en pacientes en diálisis y nunca de forma aislada (sin valorar separadamente los valores séricos de calcio y fósforo).
Hormona paratiroidea
Los valores séricos de PTHi (PTH intacta –rango normal 10-65 pg/mL en población general con el desaparecido kit clásico Allegro de Nichols–) medidos por inmunorradiometría o inmunoquimioluminiscencia, es el parámetro bioquímico (junto a la fosfatasa alcalina) que mejor se correlaciona con las lesiones histológicas de HPTS, especialmente con la actividad osteoblástica. De hecho, se podría decir que la PTH refleja directamente la actividad de paratiroides y la fosfatasa alcalina la actividad ósea.
Por esta razón, los niveles de PTH (en relación con los de calcio y fosfato) son considerados un buen marcador de la enfermedad ósea subyacente (al menos el mejor disponible, e idealmente en combinación con la fosfatasa alcalina total o fosfatasa alcalina ósea específica), evitándose así la necesidad de recurrir a la biopsia ósea diagnóstica en la mayoría de las situaciones. Esta sugerencia es especialmente relevante en estas nuevas guías en las que se plantea un tratamiento activo del riesgo de fractura de los pacientes con ERC (por ejemplo, con agentes antirresortivos). Estos deberían evitarse en caso de sospecha de enfermedad ósea adinámica (ver más adelante).
- En pacientes en diálisis, niveles de PTHi > 450-500 pg/mL (o equivalente) suelen ser específicos de enfermedad ósea de alto remodelado, concretamente la osteítis fibrosa o forma mixta; y excluyen prácticamente la enfermedad de bajo remodelado con una elevada especificidad. En un trabajo, el mejor punto de discriminación para enfermedad ósea de alto remodelado fueron niveles de PTHi > 323 pg/mL (aproximadamente 5X el límite alto de la normalidad)48. Obviamente, los valores propuestos por las guías KDIGO 2009 y 2017 (> 9X) incrementan la especificidad a expensas de otros riesgos3,4.
- En pacientes en diálisis, niveles de PTHi < 100-120 pg/mL (o equivalente) se asocian a enfermedad ósea de bajo remodelado (forma adinámica o, más raramente, osteomalacia) con un valor predictivo cercano al 90%. En un trabajo, el mejor punto de discriminación para enfermedad ósea de bajo remodelado fueron niveles < 104 pg/mL (algo menos de 2X el límite alto de la normalidad)48. Por tanto, los niveles intermedios (2X-5X-7X para unas guías o 2X-9X para otras como las KDIGO)2,4,49,50 son los de menor especificidad para la patología ósea subyacente y no se correlacionan necesariamente con los niveles asociados a mayor supervivencia. También sería conveniente reflexionar sobre el hecho de que los valores de PTH deben de ser considerados de forma relativa al tratamiento que se ha realizado para obtener el control de la PTH.
No se ha establecido una asociación entre niveles de PTH y lesiones cardiovasculares. Niveles relativamente más elevados o más bajos de PTH se han correlacionado con mayor riesgo de mortalidad, especialmente cardiovascular, aunque no hay un rango definitivamente establecido. En la antigua literatura51 se describe una asociación entre niveles elevados de PTH e hipertrofia ventricular izquierda. De este modo, en pacientes en diálisis, tanto niveles inferiores a 150 pg/mL como mayores a 300 pg/mL (aproximadamente 2X-5X el límite alto de la normalidad), según objetivos de las guías KDOQI 2003 o SEN 2011,50, se han asociado a nivel poblacional a un aumento de mortalidad. En el estudio COSMOS52 se estableció que el valor de PTH asociado a la mortalidad mínima en pacientes europeos se situaba en 398 pg/mL. Por otra parte, es necesario subrayar que existe un mayor consenso en que el remodelado óseo bajo (por ejemplo, PTH < 2X el límite bajo de la normalidad) también se asocia a calcificaciones vasculares, fracturas y mortalidad. De cualquier forma, la mortalidad asociada a elevada PTH será modulada por los niveles de P que en parte son causa del hiperparatiroidismo más severo.
Los niveles de PTH deben medirse cada seis a 12 meses en estadios 3-4 en función del valor basal y del grado de progresión de la ERC. Aunque no se vaya a modificar el tratamiento es conveniente conocer la velocidad de aumento de la PTH para tomar medidas en casos extremos o claras tendencias evolutivas. En estadio 5 (incluyendo 5D) cada tres a seis meses según recomiendan las KDIGO.
Puede ser necesaria una mayor frecuencia en pacientes bajo tratamiento, especialmente en etapa de titulación de dosis para analizar eficacia y efectos secundarios, así como para detectar o establecer tendencias. En este sentido, es importante resaltar que más que tratar valores individuales de calcio, fosfato o PTH, deberíamos tener en cuenta estas «tendencias» más que «datos aislados», que pueden ser puntualmente discordantes, así como su consideración conjunta y con los otros parámetros del complejo CKD-MBD (calcidiol, fosfatasa alcalina, calcificación vascular, etc.).
En la actualidad tenemos muchos problemas derivados de la ausencia de homogeneidad de los diferentes métodos de determinación de la PTHi42, no existiendo buenos coeficientes de correlación entre ellos, lo que dificulta la interpretación correcta de los resultados de laboratorio. La SEN elaboró un documento que pretende clarificar la interpretación de estos diferentes métodos53 y fórmulas de corrección de PTHi (disponibles en aplicaciones desarrolladas en España como «Global Nephro Calculator») respecto a la referencia «equivalente» del kit clásico usado (Allegro de Nichols) y del que se obtuvo originalmente casi toda la información derivada de esta PTH. Es importante destacar que estos algoritmos iniciales de ajuste intermétodo se establecieron en pacientes con ERC5D en hemodiálisis, y por tanto, no deben ser utilizados en otras poblaciones con ERC, donde la proporción de fragmentos de PTH (que se aclaran por el riñón) es diferente. Por lo tanto, tampoco son aplicables a pacientes en diálisis peritoneal para los que se han propuesto distintos algoritmos54.
La determinación de PTH «entera» o «bio-PTH» con métodos que cuantifican la PTH 1-84 (PTH biológicamente activa) con la interferencia de la amino-PTH (PTH 1-84 fosforilada en el aminoácido 14), así como el cálculo del cociente entre distintos fragmentos de PTH55, no se recomiendan de momento en la práctica clínica diaria. Asimismo, el uso de mediciones de PTH no oxidada (PTHi-PTH oxidada) tampoco está justificado aún en la práctica clínica55.
25 (OH) vitamina D (calcidiol)
Es aconsejable la medición de niveles de vitamina D (calcidiol) para prevenir y tratar la frecuente insuficiencia o deficiencia de esta prohormona. Los niveles de 25 (OH) vitamina D reflejan los depósitos de vitamina D y pueden variar con el grado de exposición (solar o alimentaria). Sin embargo, los niveles óptimos de 25 (OH) vitamina D y el nivel a partir del cual se consideran insuficientes siguen siendo controvertidos tanto para la población general como para los pacientes con ERC.
Extrapolando los resultados de los ensayos clínicos realizados en población general como guía principal, llegamos a la conclusión de que los niveles inferiores a 20 ng/mL (50 nmol/l) son probablemente subóptimos para la salud de los pacientes con ERC, recomendándose por debajo de este umbral el aporte nutricional o suplementos de vitamina D nativa (especialmente colecalciferol o ergocalciferol) como los recomendados para la población general. Probablemente los valores entre 20 y 40-50 ng/mL deberían ser el objetivo mínimo en pacientes con ERC aunque existe mucha controversia aún a este respecto56,57.
Se desconoce la importancia relativa de la medición con los distintos kits disponibles en el mercado, así como el valor clínico de la medición de vitamina D libre.
Los valores séricos bajos de 25-OH-vitamina D se han asociado con una mayor mortalidad global y cardiovascular en pacientes con ERC (en diálisis o no) e incluso en la población general58; sin embargo, no se ha descrito mejoría de la supervivencia con suplementación de vitamina D nativa59.
Fosfatasa alcalina
La fosfatasa alcalina total es útil, junto a la PTH, como reflejo del recambio óseo en pacientes sin enfermedad hepática. La fosfatasa alcalina ósea probablemente tiene ventajas, pero estas no necesariamente justifican el coste adicional, aunque la medición conjunta de PTHi y fosfatasa alcalina ósea es el parámetro que mejor se correlaciona con la tasa de recambio óseo en la ERC60–62. Como se ha mencionado, es posible que debamos reevaluar el uso de la fosfatasa alcalina al plantear tratamiento proactivo para la osteoporosis del paciente con ERC con el fin de evitar el uso de agentes antirresortivos en casos con elevada sospecha de enfermedad ósea adinámica (niveles de PTH y fosfatasa alcalina relativamente bajos (por ejemplo, fosfatasa alcalina ósea menor de la mediana de los límites de referencia)60–63. En un trabajo multicéntrico, el mejor punto de corte para discriminar enfermedad ósea de bajo recambio fueron valores fosfatasa alcalina ósea < 33,1 U/L48.
Se considera hoy también que la fosfatasa alcalina es un marcador de riesgo de mortalidad de carácter lineal (no en forma de U, J o J invertida como la PTH), principalmente en pacientes en hemodiálisis64, y se ha descrito la asociación independiente de niveles de fosfatasa alcalina total > 120 UI/L con calcificación coronaria65, mortalidad y otros efectos deletéreos66. La actividad elevada de fosfatasa alcalina desciende el pirofosfato sérico, importante inhibidor de la calcificación vascular, la hemodiálisis incrementa esta actividad y desciende el pirofosfato sérico incrementando el riesgo de calcificación vascular67–69. Por ello, la fosfatasa alcalina (y el relacionado pirofosfato) podrían constituir una potencial diana de tratamiento para el complejo CKD-MBD en un futuro66,70,71.
1,25-(OH)2 vitamina D (calcitriol)
No existe evidencia de que su determinación seriada sea útil para el control del paciente con ERC, aunque puede usarse con fines de investigación o en el diagnóstico diferencial de algunos casos de hipercalcemia (sarcoidosis y otras enfermedades granulomatosas, linfomas, etc.). En presencia de niveles aumentados de PTH se desconoce cuáles serían los valores normales o aconsejables, pero en presencia de ERC avanzada, niveles «normales» indican patología.
Calciuria-fosfaturia
A lo largo de la evolución de la enfermedad renal se puede producir una disminución de la capacidad excretora de calcio o de fósforo. Se ha sugerido que determinaciones seriadas de calciuria permitirían monitorizar la potencial sobrecarga de calcio en pacientes con ERC. También la previamente mencionada FEP o reabsorción tubular máxima de fósforo (TmP) (FEP normal = 10-20%) pueden ser marcadores precoces de sobrecarga de fósforo.
No obstante, cuanto mayor sea la carga de fósforo en relación al filtrado glomerular, la fracción de excreción aumentará, debido en gran parte a la acción de las fosfatoninas (FGF23, FGF7, secreted frizzled related protein 4, etc.) y PTH, que regulan la excreción renal de fósforo mediante la modulación de la expresión de los transportadores sodio-fósforo (NaPi-IIa, NaPi-IIc, y PiT-2 tipo III) en la membrana apical de las células del túbulo proximal. Pero esta fracción de excreción tiene un límite máximo (aproximadamente 50-55% en pacientes sin tubulopatías proximales) que condiciona que, ante una determinada carga de fósforo, una reducción crítica del filtrado glomerular no pueda hacer frente a la excreción, y de este modo se produzca un balance positivo de fósforo.
Los pacientes con ERC avanzada tratados con diuréticos parecen presentar concentraciones más elevadas de fosfato sérico, quizá interfiriendo de forma indirecta con la máxima capacidad compensatoria renal de excretar fosfato72. Una excreción urinaria de fósforo superior a 40 mg por cada mL/min/1,73 m2 de filtrado glomerular (por ejemplo, 400 mg de excreción urinaria de fósforo en pacientes con 10 mL/min/1,73 m2 u 800 mg en pacientes con 20 mL/min/1,73 m2 de FG) se han mostrado como buenos determinantes de hiperfosfatemia73. También se ha sugerido que para pacientes con un filtrado glomerular < 25 o 15 mL/min/1,73m2, una fosfaturia < 800 mg/día o < 600 mg/día, respectivamente, serían objetivos razonables7. Es de destacar que la cantidad total de P ingerida no se correlaciona siempre bien con la fosfaturia diaria debido a la diferente biodisponibilidad de las diferentes fuentes de P, pudiendo mejorar la correlación con el cociente fósforo/nitrógeno ureico urinario (NUU)74. Por último, destacamos que la proteinuria parece aumentar de modo independiente la retención de fósforo75.
Fibroblast Growth Factor 23 (FGF23)
Esta fosfatonina está adquiriendo relevancia no solo como importante mediadora de la fisiopatología del HPTS (su incremento precede al aumento de la PTH), sino también por su asociación a la supervivencia de pacientes con ERC, como marcador precoz de sobrecarga de fósforo o pronóstico del tratamiento del paciente con HPTS32,34,76,77. Se están describiendo no solo nuevas fuentes o reguladores del FGF23 (producción por la célula cardiaca o regulación por Ca, hierro, sodio, entre otros), sino también acciones más allá del sistema cardiovascular (infección, inflamación, etc.)78. Sin embargo, su medición en el ámbito clínico sigue sin estar recomendada, excepto en el diagnóstico diferencial de algunas patologías poco comunes. Existen kits de medición para la molécula intacta de FGF-23 y para el fragmento C-terminal79. También existen métodos automatizados de medida del FGF23 aún poco extendidos.
Klotho
Aunque se trata de una molécula de extremo interés general como correceptor del FGF23 y por sus acciones independientes que se han relacionado estrechamente con envejecimiento9, no existe aún ningún método estandarizado ampliamente aceptado para su medición. Por el momento solo tiene interés en investigación.
Calciproteínas
Su medición como parámetro de propensión a calcificación vascular y su valor clínico son todavía motivo de discusión metodológica80.
Otros marcadores del remodelado óseo
Ciertos marcadores del remodelado óseo como la osteocalcina, las piridolinas libres en suero, propéptidos y el telopéptido C-terminal del colágeno muestran buenas correlaciones con la histología ósea, pero no mejoran el poder predictivo de la PTH y/o la fosfatasa alcalina y, por tanto, su uso sistemático no está justificado60,63. Solo la fracción ósea de la fosfatasa alcalina, P1NP (marcador de formación ósea) y la fosfatasa ácida tartrato-resistente (marcador de resorción) no se acumulan en presencia de ERC por tener aclaramiento hepático60,81. El interés de su medición podría reevaluarse con la aparición de las nuevas guías para el tratamiento de la osteoporosis en la ERC63.
Técnicas de imagen. Radiología ósea y vascular (tabla 2)
Lacalcificación vascular (y su relación con la patología ósea) es clínicamente relevante y los estudios radiológicos son útiles como primer escalón de estudio para detectar calcificaciones vasculares. La radiología simple de pelvis y manos permite detectar calcificaciones vasculares (índice de Adragao, no sugerido por las guías KDIGO)82 al igual que la radiología de columna lateral lumbar (índice de Kauppila)83. Aunque no se puede distinguir radiológicamente si la calcificación afecta a la íntima vascular (secundaria a ateromatosis) o a la capa media (enfermedad de Mönckeberg o aterosclerosis), la presencia de calcificaciones en territorios de arterias elásticas (como la aorta) son más susceptibles a calcificación de la íntima84. Por el contrario, las arterias musculares (radiales y digitales) o predominantemente musculares (ilíacas y femorales) parecen más susceptibles a calcificación de la media84. Además de la asociación de toda calcificación con mortalidad u hospitalizaciones85, el índice de Adragao de manos mostró no solo su importancia pronóstica, sino también su correlación única con función renal y componentes del complejo CKD-MBD84. Se han desarrollado otros índices de calcificación aórtica torácica o abdominal86.
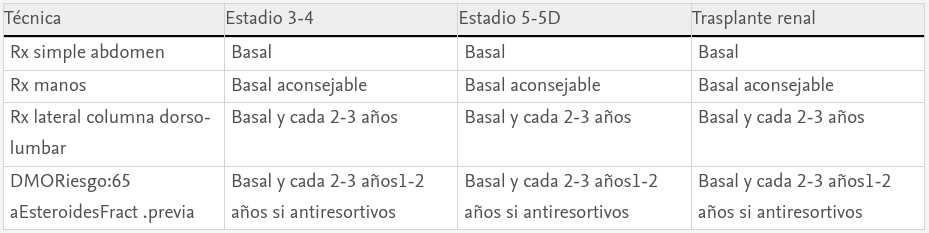
Se considera que el hallazgo de calcificaciones vasculares puede condicionar las elecciones terapéuticas posteriores, dada la posibilidad de acelerar o disminuir la progresión de calcificaciones vasculares con distintos fármacos destinados al control del complejo CKD-MBD87,88. De todos modos, se trata de un tema controvertido89; sin embargo, con un alto grado de evidencia, se sugiere que los pacientes con calcificaciones vasculares o valvulares deben ser considerados en el grupo de riesgo cardiovascular más elevado3,4.
Tanto las radiografías como el ecocardiograma pueden usarse para detectar la presencia o ausencia de calcificaciones vasculares o valvulares y constituyen alternativas razonables y económicas a la tomografía computarizada3,4, aunque tienen un bajo poder predictivo negativo (si son negativas no podemos asegurar ausencia de calcificaciones).
Desde el punto de vista óseo, la resorción subperióstica en la cara radial de las falanges es el signo más precoz y específico de osteítis fibrosa. Otras lesiones clásicas como son la acrosteólisis, cráneo en «sal y pimienta», vértebras en «jersey de rugby», apoyan el diagnóstico de osteítis fibrosa. Por otra parte, las líneas de Looser son propias de la osteomalacia. Todas ellas suelen ser manifestaciones tardías de la enfermedad ósea subyacente. La ampliación radiológica de la columna lumbar previamente mencionada (índice de Kauppila) a la columna dorsal está indicada en pacientes sintomáticos o con elevado riesgo de fractura para la detección de fracturas vertebrales (las llamadas fracturas morfométricas vertebrales, frecuentemente asintomáticas).
Densitometría ósea
La absorciometría de rayos X dual (DXA) es actualmente el método estándar para determinar la densidad mineral ósea (DMO) en la población general. Esto se debe a que ofrece determinaciones precisas en sitios clínicamente importantes y con mínima radiación. Se determina habitualmente en cuello femoral y en columna vertebral (proyecciones antero-posteriores y laterales). Proporciona información de cambios en el contenido mineral óseo, pero no del tipo de enfermedad ósea subyacente y esto es una consideración especialmente importante en el paciente con ERC90.
En la población general se define osteoporosis por la presencia de una DMO con un T score menor a -2,5 desviaciones estándar. Una porción significativa de fracturas se produce también en el rango de osteopenia (T score entre -1 y -2,5 desviaciones estándar). Es necesario recordar que los T score se deberían evaluar solo en fémur total, cuello femoral o columna lumbar (o radio ultradistal en hiperparatiroidismo –ver posteriormente–) para el diagnóstico y tratamiento de la osteoporosis de acuerdo a la clasificación de la Organización Mundial de la Salud (OMS) porque no son equivalentes a otros T score63,90. Además, por ello, los distintos aparatos usados deben estar validados independientemente para valorar el riesgo de fractura. Este dato es importante a tener en cuenta con la aparición de las densitometrías corporales totales. En las densitometrías óseas convencionales, existen otros datos asociados como el Trabecular Bone Score (TBS) o la morfometría densitométrica vertebral, que pueden ayudar a precisar el riesgo de fractura63,90.
Diversos trabajos recientes han demostrado de forma consistente la relación de la DMO con el riesgo de fractura también en la población con ERC. También se ha demostrado que los antirresortivos aumentan la DMO en pacientes con ERC y que sus beneficios, aún sin disponibilidad de biopsias óseas, podría superar los riesgos del mismo4,63,90,91. Por ello, guías actuales (KDIGO 2017) sugieren la práctica de DMO por DXA en pacientes con ERC 3a-5D con evidencia de CKD-MBD y/o factores de riesgo para osteoporosis (entre los que destaca la edad ≥ 65 años y el antecedente de una fractura previa) para valorar el riesgo de fractura si los resultados impactaran sobre decisiones terapéuticas4. Asimismo, se han publicado diversos algoritmos al respecto61,90,92, incluso recientemente un consenso europeo para el diagnóstico y manejo de la osteoporosis en pacientes con ERC estadios 4-5D63.
El riesgo de fractura mayor osteoporótica o de cadera a los 10 años en la población general (o la posible indicación de solicitar la medición de la DMO por DXA) se puede valorar usando la Fracture Risk Assessment Tool (FRAX, https://www.sheffield.ac.uk/FRAX/tool.aspx?country=4). Es posible que esta herramienta pueda usarse en pacientes con ERC93,94 y que pueda infraestimar el riesgo real.
No existe consenso sobre el umbral de FRAX indicador de practicar una densitometría. Podríamos considerar inicialmente un riesgo a los 10 años de fractura de cadera > 3% y/o fractura mayor osteoporótica (vertebral, antebrazo, cadera u hombro) > 7,5%90. En caso de realizarse la densitometría, probablemente se debería recalcular el FRAX incorporando el resultado de la densitometría, de cara a proponer un tratamiento.
Actualmente se sabe que la ERC aumenta la prevalencia e incidencia de fracturas por osteoporosis, la ocurrencia a edad más temprana y que se asocia a una mayor mortalidad, incluso en ausencia de anormalidades metabólicas persistentes.
Además de la DMO medida en fémur o en la columna lumbar, la pérdida de hueso cortical (el más afectado en los pacientes con ERC con hiperparatiroidismo) se mide de un modo más preciso (pero secundario) en el radio ultradistal63,95 y se correlaciona (negativamente) con la PTH en pacientes en hemodiálisis96. De cualquier forma, esta correlación puede ser inexistente y puede tener poco valor porque un valor puntual de PTH no refleja la historia de cambios de esta hormona, mientras que la DMO refleja de forma acumulativa los cambios de DMO que han ocurrido a lo largo de un tiempo mayor. De usarse, el radio distal podría proporcionar información adicional en los pacientes con ERC, pero evitando el brazo de la fístula A-V funcionante97.
Histología (biopsia ósea)
La biopsia ósea de cresta ilíaca con doble marcaje con tetraciclinas y el estudio histomorfométrico son el método más preciso para el diagnóstico de la lesión ósea subyacente y el «patrón de oro» para estudiar el valor predictivo de otras técnicas diagnósticas menos invasivas.
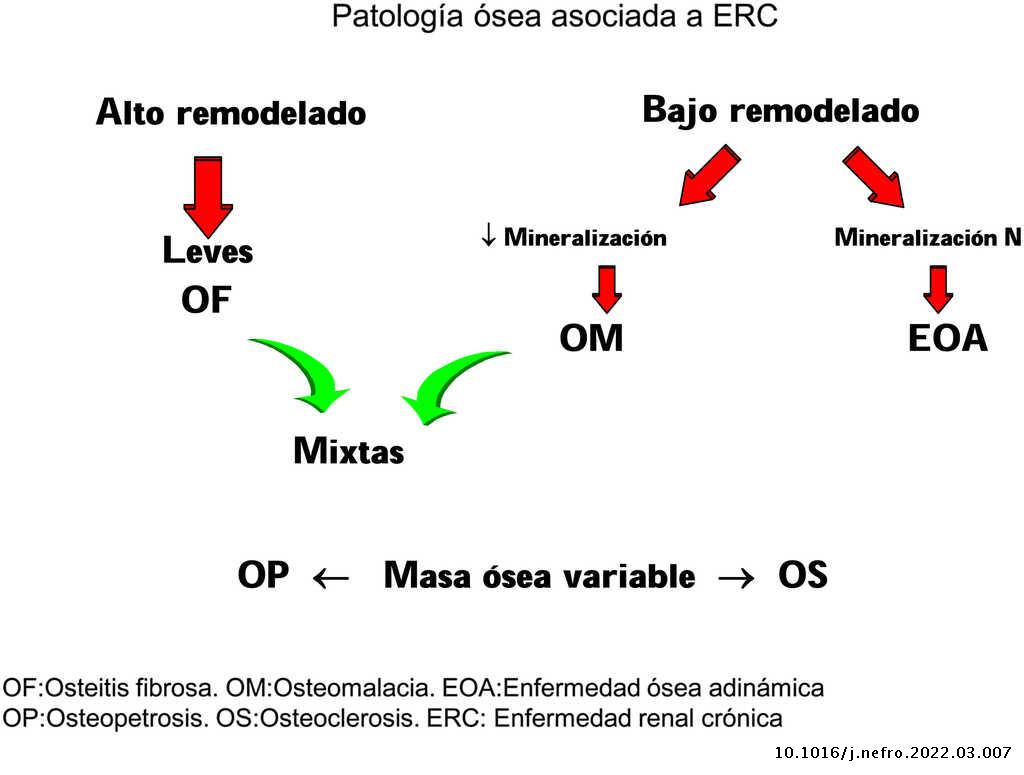
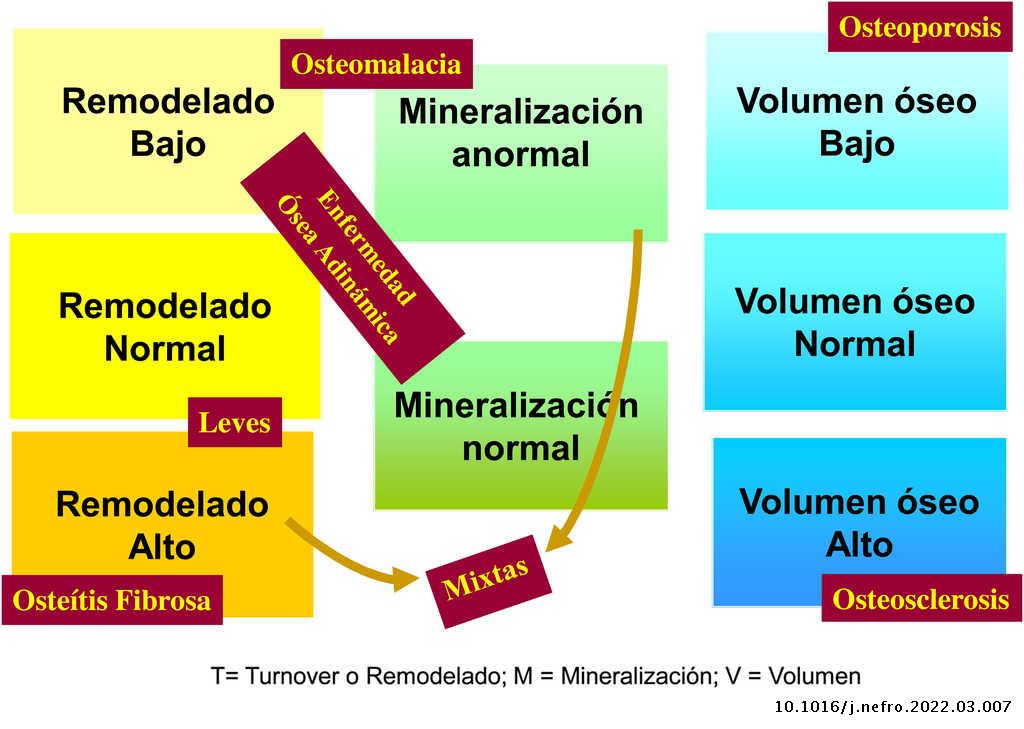
La aplicación de criterios histomorfométricos ha hecho posible uniformar las clasificaciones de la ODR. Actualmente este término, como ya se mencionó en la introducción, se aplica exclusivamente para definir las alteraciones histomorfológicas óseas asociadas a la ERC, e incluye parámetros de remodelado óseo, tasa de mineralización y volumen óseo (cantidad de hueso por unidad de volumen de tejido óseo total). Actualmente se usa la clasificación TMV para la valoración histomorfométrica del hueso (T = turnover, M = mineralization, V = bone volume)2–4.
Clásicamente las lesiones óseas se clasificaban en (fig. 1): formas de alto remodelado (AR) y bajo remodelado (BR). Dentro de las formas de AR, la forma más característica es la osteítis fibrosa (OF) y su única causa, el HPTS. Las formas de BR se subdividen en función de la tasa de mineralización. Si cursan con mineralización normal se denominan enfermedad ósea adinámica (EOA) y si cursan con disminución de la mineralización –con el aumento consiguiente de tejido osteoide–, osteomalacia (OM). A su vez, todas las alteraciones morfológicas pueden cursar con masa ósea variable, generalmente disminuida, por lo que la densitometría por DXA no es capaz de distinguir entre los distintos tipos de ODR90.
La clasificación KDIGO de ODR (fig. 2) tiene en cuenta remodelado, mineralización y volumen óseo.
Indicación de biopsia ósea
Aunque ya hemos mencionado que se trata del «patrón de oro» diagnóstico, el mejor conocimiento de la enfermedad y del valor predictivo de los parámetros bioquímicos han logrado que la biopsia ósea sea de indicación excepcional, aunque actualmente se la intenta revitalizar98.
Las recomendaciones elaboradas por la SEN, así como las KDIGO3,50 han mostrado ser de ayuda limitada en la toma de decisiones. La enfermedad ósea inducida por aluminio virtualmente ha desaparecido con el tratamiento del agua de diálisis, los conceptos previamente definidos como «inexplicables» o «parámetros bioquímicos no concluyentes» ayudan poco a la toma de decisión de tomar biopsia. Asimismo, la indicación de biopsia antes del uso de agentes antirresortivos es cuestionada actualmente4,91.
Por lo tanto, a pesar de su indudable valor diagnóstico, la indicación de biopsia ósea debe ser individualizada en el contexto de casos clínicos donde su valor diagnóstico sea relevante para la toma de decisiones terapéuticas o pronósticas para el enfermo, así como para investigación, con el ánimo de probar y respaldar medidas terapéuticas que se puedan generalizar a otros pacientes.
A considerar:
a) Manifestaciones clínicas: fracturas patológicas y/o dolores óseos persistentes (especialmente notorios en casos de osteomalacia), alteraciones radiológicas no explicadas por ODR o alteraciones bioquímicas discordantes con el patrón de presentación de la ODR. Todas estas circunstancias conllevan la exploración de otra enfermedad ósea de origen metabólico.
Estos pueden ser ejemplos:
– Alto remodelado: a) oxalosis: imágenes radiológicas severas de osteítis fibrosa, con PTH anodina. El diagnóstico genético antecede a la biopsia, pero puede no ser concluyente. b) enfermedad de Paget, en función de su presentación.
– Bajo remodelado: a) raquitismo/osteomalacia. b) hipofosfatemia crónica sin manifestaciones clínicas o poco evidentes, con estudio genético no concluyente.
b) Hipercalcemia persistente no iatrogénica de etiología incierta, con PTH suprimida y potencial enfermedad sistémica no etiquetada.
c) Eventual exposición a tóxicos de potencial efecto sobre el esqueleto (aluminio, metales pesados, etc.).
d) Diseños experimentales o de relevancia diagnóstico-terapéutica, como el estudio del potencial efecto de fármacos sobre daño óseo de origen metabólico (fármacos antirresortivos, anabolizantes óseos). Como se ha mencionado con anterioridad, es razonable realizar una biopsia ósea en pacientes con ERC 3a-5D si el conocimiento del tipo de ODR impactara sobre las decisiones terapéuticas4,99.
Sin embargo, las guías actuales consideran que la ausencia de una biopsia ósea no puede ser un factor limitante para prescribir un tratamiento antirresortivo a un paciente con alto riesgo de fractura4,91.
Otras técnicas de imagen
No hay guías de actuación clínica consensuadas para la evaluación y seguimiento de las calcificaciones extraóseas en la ERC.
Radiografías simples: mencionadas con anterioridad, los índices de Adragao y de Kauppila, entre otros, tienen valor pronóstico, por lo que se sugiere su práctica en todos los pacientes con ERC. Estarían particularmente indicadas en caso de poder ayudar a la toma de decisiones terapéuticas (uso de distintos captores de fósforo o derivados de la vitamina D, calcimiméticos, etc.) y en pacientes en lista de espera de trasplante renal. Su limitación es la baja sensibilidad y el carácter subjetivo de los métodos semicuantitativos100, por lo que son poco útiles para seguimiento prospectivo.
Otros instrumentos para el diagnóstico por imagen se emplean en función de la disponibilidad en los sitios de trabajo, la experiencia del operador y el tipo de diseño del estudio a realizar.
- Mamografía: especialmente útil en mujeres, proporciona una posibilidad única de valorar calcificación de la media arterial100.
- Ecocardiograma: útil para evaluar las calcificaciones valvulares, e igualmente la geometría y función cardiaca.
- Ecografía carotídea: detecta calcificaciones en placas de ateroma y permite medir el grosor íntima-media en vasos carotídeos. Permite también la localización de la calcificación en la placa de ateroma o incluso la presencia de calcificaciones que afectan solo la lámina elástica interna.
- Velocidad de la onda del pulso carótido-femoral (VOP): se usa para medir la rigidez (o pérdida de distensibilidad) arterial. Es un método no invasivo, inocuo para el paciente, de fácil realización y alta reproducibilidad. Existe correlación entre la VOP y el grado de calcificación vascular.
- Índice tobillo-brazo: la disminución del índice tobillo-brazo sugiere la presencia de enfermedad arterial periférica y frecuentemente se asocia a calcificación vascular (al igual que el aumento de la presión de pulso).
- Técnicas de angiotomografía: esta modalidad, menos invasiva que la arteriografía, proporciona imágenes de buena calidad para el estudio morfológico del árbol vascular.
- TAC helicoidal o tomografía con multidetectores: considerada como el «patrón de oro» para el estudio de la calcificación vascular al tratarse de una técnica ampliamente disponible con una alta sensibilidad100. Es útil para la valoración de calcificaciones coronarias71, siendo posible valorar la progresión de la superficie (índice de Agatston) o el volumen calcificado (índice de Raggi)101,102.
- Electron-beam computed tomography (EBCT): la mejor técnica validada para la detección de calcificaciones coronarias, pero de elevado coste.
Valores bioquímicos recomendados según diferentes estadios
Los valores séricos recomendados, según las KDOQI, KDIGO y revisión de la literatura, son los que se muestran en la tabla siguiente (tabla 3). No existen evidencias claras, especialmente antes de diálisis, para aconsejar unos valores bioquímicos determinados, especialmente de PTH.

Algunos autores han recomendado la normalización de los valores de PTH, otros el inicio de tratamiento al observarse un cierto grado de aumento de la PTH respecto a una determinación basal si se dispone de ella (aún dentro del rango de la normalidad). Actualmente se considera que un aumento moderado de la PTH es necesario, como mecanismo adaptativo, para mantener una tasa de remodelado óseo normal (además de su efecto fosfatúrico y estímulo de la 1-α-hidroxilasa) ante la presencia de resistencia (hiporrespuesta) a la acción de la PTH en la ERC4,103,104.
En cualquier caso, las recomendaciones sobre los parámetros bioquímicos se basan en trabajos observacionales que, en realidad, solo nos pueden hablar de asociaciones. Dada la importante y uniforme asociación con mortalidad de los niveles alterados de calcio y fósforo en pacientes con ERC sugerimos mantener los niveles de calcio y fósforo en el rango normal de laboratorio en pacientes con ERC 3a-5, siempre que las medidas para conseguirlo sean razonables.
No hay que olvidar que los objetivos terapéuticos de las alteraciones del metabolismo óseo mineral deben adecuarse a las características clínicas y objetivos terapéuticos globales de cada paciente, sin que se deba únicamente perseguir el alcanzar determinadas cifras o concentraciones plasmáticas. Como se ha comentado con anterioridad, en pacientes con ERC 3a-5D, los tratamientos deberían basarse en determinaciones seriadas de calcio, fósforo y PTH (además de calcidiol y fosfatasa alcalina) en su conjunto y valorando tendencias4.
Respecto al calcio, una excepción sería la presencia de hipocalcemia en pacientes tratados con calcimiméticos (estadio 5D), en los que un cierto grado de hipocalcemia no solo es tolerable, sino que incluso podría resultar beneficioso38,101, motivo por el que las nuevas guías KDIGO 2017 expresan «evitar hipercalcemia», en lugar de aconsejar la normalidad del calcio en todos los pacientes4.
En relación con el fósforo, las guías KDIGO 2017 sugieren, de un modo un tanto ambiguo, que en los pacientes con ERC 3a-5D se deberían descender los niveles de fósforo «hacia la normalidad»4. Nosotros consideramos que los niveles de fósforo deberían normalizarse siempre que fuera posible con medidas razonables.
Alternativas terapéuticas
Dieta
En pacientes con ERC, donde la excreción urinaria de fósforo está gravemente comprometida, la absorción digestiva va a ser uno de los principales factores determinantes de los niveles de fósforo en sangre. Aunque los pacientes con ERC estadio 5 solo absorben aproximadamente el 60% del fósforo ingerido (frente al 80% de la población general), la capacidad de absorción aumenta con el uso de vitamina D105.
Dentro de las fuentes de fósforo, se distingue el fósforo orgánico, presente en los alimentos ricos en proteínas, como la carne, los lácteos, los huevos, los cereales, las legumbres y los frutos secos. Es de especial importancia el fósforo inorgánico, incluido en los aditivos alimentarios de los alimentos procesados y refrescos, dada su elevada biodisponibilidad y absorción. Cualquier estrategia para controlar la ingesta dietética de fósforo debe contemplar no solo el contenido de fósforo en los alimentos, sino también su biodisponiblidad; esta última es muy importante debido al incremento de utilización de productos procesados y de bebidas.
Como la cantidad de fósforo en la dieta se relaciona directamente con la cantidad de proteínas en la dieta, la restricción de fósforo muchas veces se asocia a un descenso en la ingesta proteica, comprometiendo la supervivencia y la calidad de vida de los pacientes con ERC106,107. De este modo, el cociente fósforo/creatinina o el recientemente descrito fósforo/NUU, previamente mencionado, representan un mejor método de medida que el simple contenido de fósforo de los alimentos74,107. Existe una gran variabilidad en el cociente fósforo/proteína entre las distintas fuentes de proteínas. La clara de huevo y las proteínas de origen animal, excluyendo lácteos, son una fuente de proteínas con bajo cociente fósforo/creatinina. Por el contrario, la yema de huevo, las proteínas derivadas de la leche, las legumbres y la comida rápida son alimentos con alto cociente. El fosfato de origen vegetal (también orgánico y en su mayor parte asociado a fitatos) es menos absorbible en el tracto gastrointestinal humano4,108, por lo que también podría contemplarse el contenido de fitato en los cálculos dietéticos de los distintos patrones alimentarios en pacientes con ERC109.
A diferencia del fósforo orgánico, el inorgánico no va ligado a proteínas, alcanzando una biodisponibilidad de prácticamente el 100%, por lo que insistimos en la necesidad de evitar alimentos procesados por su alto contenido de aditivos.
En cualquier caso, la restricción en la ingesta de fósforo nunca debe hacerse a costa de una excesiva restricción de la ingesta proteica, ya que los riesgos asociados a malnutrición pueden superar los beneficios derivados de una menor carga de fósforo.
Vitamina D nativa/calcifediol
Los niveles adecuados de 25(OH)D son especialmente importantes, ya que serán el sustrato para la producción de 1-25(OH)2 D, además de que su déficit agrava el HPTS. En estadios precoces, el déficit de 25(OH)D puede ser la única causa de HPTS y, por tanto, parece aconsejable su medición, así como iniciar su suplementación siguiendo las recomendaciones de la población general110 para asegurar los efectos pleiotrópicos de la vitamina D más allá del control del HPTS. Es bien conocido que el RVD es ubicuo y se expresa en muchos tejidos además de los clásicos. Con la edad disminuyen los RVD de piel y de músculo, hecho que refuerza la necesidad de tener niveles óptimos de esta hormona. La repleción de vitamina D es especialmente importante en caso de implementar tratamientos para la osteoporosis en pacientes con ERC, al aumentar la eficacia de dichos fármacos y evitar efectos secundarios indeseados como la hipocalcemia (principalmente inducida por denosumab)111.
No obstante, no existe acuerdo total en la necesidad de suplementación con vitamina D nativa (colecalciferol/ergocalciferol) o calcidiol/calcifediol en la población general y en pacientes con ERC (especialmente avanzada)59,112–114, ni en los niveles objetivo en la ERC56,57. Ya hemos comentado que nuestra recomendación se basa en la posibilidad de hidroxilación extrarrenal y sus efectos pleiotrópicos auto- o paracrinos y no solo en el control del HPTS.
Añade aquí tu texto de cabecera
En cuanto al aporte de calcio, es imprescindible un aporte suficiente para reducir la estimulación de la PTH. Sin embargo, debemos tener en cuenta que los pacientes con ERC presentan una disminución de la excreción urinaria de calcio115,116, por lo que como mínimo deberíamos evitar aportes de calcio superiores a los recomendados en la población general110.
Captores de fósforo
- El acetato cálcico muestra un poder captor similar al carbonato cálcico pero con una menor sobrecarga de calcio, por lo que tendría ciertas ventajas, además de su mayor efecto en distintos rangos de pH. El carbonato de calcio es, por otra parte, el más barato de los captores.
- En estos momentos ya tienen indicación en etapa prediálisis el carbonato de lantano y el carbonato de sevelamer (aunque la ficha técnica especifica valores de fosfato > 1,78 mmol/L [5,5 mg/dL]).
- Sevelamer, del que ya existen genéricos, es un captor de fósforo que no contiene ni calcio ni aluminio. Se trata de un polímero que se une al fósforo a nivel intestinal e impide su absorción. Varios estudios prospectivos y metaanálisis muestran que es capaz de atenuar la progresión de calcificaciones coronarias y aórticas117 y también reduce los niveles de lípidos y mejora el perfil inflamatorio118, entre otros múltiples efectos pleiotrópicos demostrados a nivel clínico y experimental119,120.
- El sevelamer se presentó inicialmente como clorhidrato de sevelamer y tiene el inconveniente de tener una eficacia limitada, lo que conlleva que en muchos casos se necesite tomar un elevado número de comprimidos que pueden ser mal tolerados por los pacientes. Es posible que dosificaciones en forma de carbonato de sevelamer (polvo para suspensión oral incluso triplicando la dosis) mitiguen este problema. El polvo puede mezclarse con una pequeña cantidad de comida tibia.
- Es de destacar que un estudio y varios metaanálisis muestran una mejoría de supervivencia en los pacientes incidentes en diálisis tratados con sevelamer, en comparación con captores cálcicos121–123, si bien otros estudio prospectivos y metaanálisis limitan la mejoría de la supervivencia a determinadas subpoblaciones (población de más de 65 años) o incluso la cuestionan37,124.
- Carbonato de lantano, es un captor de fósforo potente que no contiene ni aluminio ni calcio y ofrece la posibilidad de mejorar el control del fósforo sérico sin efectos secundarios relevantes como han mostrado diferentes estudios publicados125. Estudios observacionales y metaanálisis parecen también mostrar efectos beneficiosos sobre la atenuación de la progresión de calcificación vascular y supervivencia con carbonato de lantano en comparación con captores de fósforo cálcicos126,127.
- Tras la experiencia prolongada con su uso en clínica han desaparecido en gran parte los temores iniciales sobre su posible toxicidad, constituyendo una alternativa eficaz para el tratamiento de la hiperfosfatemia. Tiene una formulación en polvo que puede mezclarse fácilmente con la comida y podría favorecer la adherencia al tratamiento.
- La asociación de acetato de calcio con carbonato de magnesio, con indicación para pacientes en diálisis, disminuye el aporte de calcio, muestra buenos resultados y no se ha asociado a problemas derivados de la posible hipermagnesemia, habiéndose acompañado además de disminución de los niveles de PTH128. Se han descrito también potenciales efectos anticalcificantes del magnesio, tanto en estudios experimentales como en estudios preliminares clínicos129,130. Se aconseja la monitorización del magnesio sérico y del ECG en pacientes tratados con digital. Pudiera tratarse del captor de elección en pacientes con hipomagnesemia (parámetro también asociado a un aumento de mortalidad y no inhabitual en pacientes en diálisis)131. Además, el magnesio podría disminuir la toxicidad del fosfato132.
- Captores basados en hierro. Los captores de fosfato basados en hierro carecen de los efectos pleiotrópicos mencionados. Son relativamente bien tolerados (sobre todo debido al uso de un menor número de comprimidos, por ejemplo en comparación con el clorhidrato de sevelamer), aunque el color oscuro de las heces y la diarrea (a diferencia de otros captores) son sus efectos secundarios más frecuentes y pueden condicionar su uso en algunos pacientes. Entre los dos captores de fosfato basados en hierro (oxihidróxido sucroférrico y citrato férrico) existen diferencias significativas, especialmente en relación a su potencia como captor de fósforo (superior para oxihidróxido), absorción de hierro (mayor para citrato) y número de comprimidos (menor para oxihidróxido). Por el momento, solo el oxihidróxido sucroférrico está disponible en España. La unión del fosfato al complejo es fuerte y poco soluble y presenta una excelente capacidad de unión al fosfato por unidad prescrita133.
El oxihidróxido sucroférrico parece presentar un menor riesgo de interacciones medicamentosas, aunque como todos los captores de fosfato interfiere con la absorción de levotiroxina134.
Hasta el momento, no hay ningún trabajo que demuestre de forma convincente cuál debe de ser el captor de primera elección, por lo que se debería tener también en cuenta de forma individual las características, limitaciones y preferencias del paciente135. El uso de cualquier captor de fósforo (excepto los basados en aluminio) se ha asociado a una mejoría de la supervivencia en múltiples estudios en pacientes en diálisis136,137, aunque no se puede descartar que este efecto sea debido a que la toma de captores de fósforo permite una dieta algo más liberal y, por tanto, se podría asociar a un mejor estado nutricional. Se considera que, dada la presencia de numerosas alternativas disponibles y la incapacidad de determinar una dosis segura, el uso prolongado de captores de fósforo con aluminio debería evitarse4.
Frecuentemente, la hiperfosfatemia se trata con una asociación de varios de estos captores para disminuir el coste asociado al uso de los captores sin calcio, aunque tampoco existe una clara evidencia de una mayor efectividad de su uso combinado136. En cualquier caso, continuamos considerando razonable que en la elección del captor se tenga en cuenta el estadio de ERC, la presencia de otros componentes del complejo CKD-MBD (por ejemplo, la calcificación vascular), terapias concomitantes (derivados de la vitamina D, calcimiméticos, interacciones medicamentosas) y el perfil de efectos secundarios4. Subrayamos el aumento de evidencia en las guías KDIGO 2017 que sugieren la necesidad de restringir el uso de captores basados en calcio en adultos con ERC4, dada la publicación de numerosos estudios y metaanálisis que favorecen el uso de captores sin calcio122,123,138. Esta restricción es especialmente necesaria en pacientes con hipercalcemia persistente o recurrente, sospecha de EOA y/o si los niveles séricos de PTH son persistentemente bajos. Asimismo, las nuevas guías KDIGO 20174 sugieren que las decisiones sobre el uso de tratamientos para disminuir el fósforo deberían basarse en aumentos persistentes o progresivos de la fosfatemia y, aunque reconocemos la presencia de una sobrecarga corporal de fósforo antes de que aparezca hiperfosfatemia, a la luz del conocimiento actual no está aún justificado el tratamiento «preventivo» (por ejemplo, basado en niveles elevados de FGF23 con fósforo plasmático normal)4,139–141. No obstante, es de destacar que solo los captores sin calcio se han asociado a descensos de FGF23.
Si no fuera suficiente se puede utilizar hidróxido de aluminio durante un corto periodo, administrándolo solo en las comidas cuyo contenido en fósforo lo justifique. La cantidad segura de captores con aluminio se desconoce. El aluminio sérico debería medirse dos veces al año en aquellos pacientes que reciban captores de fósforo que lo contienen. Valores basales de aluminio sérico < 20 μg/L indican una probable ausencia de sobrecarga de aluminio. Valores repetidos entre 20-60 μg/L son de difícil interpretación. Los valores consistentemente > 60 μg/L indican una sobrecarga alumínica (esto no siempre implica enfermedad ósea por aluminio)50.
En pacientes con depleción de hierro, el riesgo de incorporación tisular de aluminio es mayor, por lo tanto, valores muy inferiores a los ya mencionados pueden tener un significado patológico142.
Metabolitos activos de vitamina D
Si la PTH aumenta de modo progresivo y persistente a pesar de la corrección de factores modificables (hiperfosfatemia, ingesta excesiva de fósforo, hipocalcemia, déficit de vitamina D), el tratamiento con metabolitos activos de la vitamina D o activadores selectivos del receptor de la vitamina D (AsRVD) podría estar indicado. Dosis bajas de metabolitos activos no suelen provocar hipercalcemia ni hiperfosfatemia y han mostrado, en estudios experimentales, que podrían incluso disminuir la progresión de la ERC entre muchos otros efectos pleiotrópicos143. Una forma de determinar que la dosis de vitamina D es inapropiadamente alta puede ser determinar la calciuria y habría que ser muy cuidadosos en pacientes que toman captores de fósforo cálcicos. La administración de vitamina D se ha asociado con un aumento de la supervivencia a pesar de aumentar los niveles de FGF23, pero no hay estudios clínicos que nos puedan indicar si medir los valores de FGF23 podrían ayudar a decidir una dosis más apropiada de vitamina D. Además, es difícil generalizar sobre las distintas funciones y diferencias entre los distintos metabolitos de la vitamina D, así como separar sus actividades endocrinas de las paracrinas o autocrinas.
En este sentido, tanto el uso de calcitriol como de α-calcidol se ha asociado, en estudios observacionales, con mejor supervivencia de pacientes con ERC no en diálisis144–146.
El paricalcitol (19-nor-vitamina D2) posee diferentes afinidades sobre el RVD, presentando mayor afinidad a nivel de células paratiroideas respecto a osteoblastos, células de pared intestinal y células musculares lisas vasculares. Por ello parece ser algo menos hipercalcemiante e hiperfosforemiante que el calcitriol, como se ha demostrado fundamentalmente en diferentes estudios experimentales147. Además, en otros, paricalcitol ha mostrado ser capaz de inducir menos calcificaciones vasculares comparado con dosis equipotentes de calcitriol147–149, probablemente debido a su efecto diferencial sobre proteínas óseas morfogénicas y la vía de Wnt149.
Su uso se ha asociado no solo al control del HPTS, sino también a otros efectos pleiotrópicos como la disminución de la proteinuria en orina de 24 h en pacientes diabéticos150, probablemente asociado a su efecto antirrenina, aunque los resultados de estos estudios son todavía no concluyentes y podrían deberse a un efecto de clase151. Por otro lado, aunque todos los derivados activos de la vitamina D se asocian con mejoría de la supervivencia de los pacientes con ERC en la gran mayoría de estudios publicados (observacionales y metaanálisis tanto en estadios 3a-5 como 5D)152,153, las mejores asociaciones sobre supervivencia se han observado en pacientes en diálisis tratados con paricalcitol154. No todos los estudios demuestran que el aporte de vitamina D se asocia con menor progresión de la insuficiencia renal y en algún estudio se ha observado que la velocidad de descenso del filtrado glomerular en pacientes con ERC disminuyó tras la retirada de la vitamina D activa155.
Es de destacar que las guías KDIGO 20174, a raíz de la elevada frecuencia de episodios de hipercalcemia en los estudios PRIMO y OPERA con el uso de altas dosis de paricalcitol (1-2 μg/día) y/o captores cálcicos en pacientes con HPTS muy leve-moderado156,157, han sugerido que en adultos con ERC 3a-5 no se deberían usar de modo rutinario calcitriol o análogos de la vitamina D y reservarlos para pacientes con hiperparatiroidismo grave y progresivo4.
Los autores de estas recomendaciones manifiestan su desacuerdo con este último criterio, considerando que en dichos estudios se usaron dosis inapropiadamente altas de paricalcitol para valorar su posible efecto beneficioso sobre la hipertrofia ventricular izquierda y no sobre el HPTS, y que por ello no se justifica, es más, sería un error esperar a que el HPTS sea grave para prevenir su progresión. Los estudios moleculares de hiperparatiroidismo severos así lo indican158,159, así como estudios clínicos recientes160.
Por el contrario, los autores de estas guías consideran más apropiado sugerir que no es aconsejable la normalización completa de los niveles de PTHi en la ERC, dada la presencia de hiporrespuesta o resistencia a la acción de la PTH (como ocurre con otras hormonas –insulina, hormona del crecimiento, FGF23, vitamina D–)103,104 y que, como se ha mencionado con anterioridad, un discreto aumento de PTH puede tener acciones beneficiosas al aumentar la fosfaturia, la síntesis de calcitriol o normalizar la tasa de formación ósea.
Sin embargo, reconocemos que, especialmente en ERC estadios 3a-5, no se sabe aún cuál es el nivel óptimo de PTHi1,4,50 lo que no justifica tener que esperar a un HPTS «grave» para iniciar tratamiento.
Calcimiméticos: cinacalcet y etelcalcetida
Cinacalcet es un calcimimético oral que se une al RSCa de la glándula paratiroidea y lo modifica alostéricamente, de manera que lo hace más sensible a las acciones del calcio extracelular. Etelcalcetida es un pequeño péptido sintético, administrado por vía endovenosa al final de la sesión de diálisis que activa el RSCa incluso en ausencia de calcio; sin embargo, la señalización es mayor en presencia de calcio, por lo que su acción alostérica parece ser también la principal161.
Los calcimiméticos reducen de forma significativa los valores séricos de PTH y, como consecuencia, los de calcemia y eventualmente también de fosfatemia y FGF-23162–166. A nivel experimental y clínico se han descrito también distintos efectos pleiotrópicos, entre los que destaca su efecto atenuante sobre la progresión de la calcificación vascular y valvular101,167,168. Además, en diversos estudios clínicos el uso de cinacalcet se ha asociado a una disminución significativa de paratiroidectomías, fracturas, hospitalizaciones de causa vascular y mejoría nominalmente significativa de la supervivencia, al menos en algún subgrupo (≥ 65 años) de pacientes en diálisis38,169–172. Asimismo, se ha descrito una posible reducción del tamaño y vascularización de las glándulas paratiroides173.
Entre los efectos secundarios del cinacalcet destacan la intolerancia gastrointestinal, que en algunos casos ha obligado a suspender el fármaco, y la potencial aparición de hipocalcemia sintomática38,172, por lo que se debe ser prudente en pacientes con factores de riesgo a presentar un intervalo QT alargado o pacientes con epilepsia172. La intolerancia gastrointestinal mejora con la administración después de la comida principal y, en algunos casos, de la cena o en dosis divididas. El etelcalcetida endovenoso no mostró diferencias significativas respecto a cinacalcet174, pero la experiencia clínica parece demostrar que pacientes intolerantes a cinacalcet pueden tolerar etelcalcetida e incluso permitir la detección de pacientes no adherentes al cinacalcet oral175.
Por otra parte, cinacalcet se metaboliza a través del citocromo P450, por lo que la inhibición de esta enzima puede resultar en aumento de sus niveles (ketaconazol, itraconazol, cimetidina, claritromicina, ritonavir, zumo de pomelo), mientras que su activación (por barbitúricos, fenitoína, carbamazepina, dexametasona, rifampicina) resultaría en una disminución de los mismos. Debe valorarse también el ajuste de dosis de fármacos metabolizados por CYP2D6 de margen terapéutico estrecho y que requieran ajuste individual de dosis (flecainida, quinidina, antidepresivos tricíclicos, vinblastina, tioridazina, propafenona, metoprolol, etc). La etelcalcetida no presenta estos problemas.
En los pacientes que reciben calcimiméticos se deben realizar controles más frecuentes de calcemia al inicio del tratamiento.
Paratiroidectomía
La paratiroidectomía se debe considerar si todas las medidas anteriormente mencionadas son ineficaces para controlar la PTH. Hoy en día, con la introducción de las nuevas alternativas de tratamiento médico, las indicaciones podrían quedar reducidas a:
Hiperparatiroidismo secundario severo (PTH > 800-1.000 pg/mL –sin hipocalcemia–) en diálisis sin respuesta al tratamiento médico combinado (asociación de calcimiméticos, captores del fósforo y derivados de la vitamina D) durante más de seis meses.
- Hiperparatiroidismo terciario resistente a calcimiméticos o tratamiento combinado
- Hiperfosfatemia severa refractaria.
- Hiperparatiroidismo primario (hipercalcemia no iatrógena con PTH no suprimida) en pacientes con ERC (especialmente jóvenes con criterios quirúrgicos). En estos casos existe la posibilidad de cirugía mínimamente invasiva si la gammagrafía con sestamibi, la ecografía paratiroidea o el PET-scan son positivas.
- Paciente con calcifilaxis y PTHi superior a 500 pg/mL que no responden rápidamente al tratamiento con calcimiméticos.
- Complicaciones asociadas al HPTS como:
- ruptura tendinosa,
- dolor óseo severo o
- anemia refractaria
Se recomiendan técnicas de imagen previas a la paratiroidectomía para valorar tamaño glandular, situación y, sobre todo, presencia de glándulas ectópicas176. La asociación de gammagrafía-MIBI y/o SPECT-TAC y/o ecografía cervical muestran una gran sensibilidad y especificidad. El uso de PET-scan con diferentes trazadores (11C-metionina, 18F-fluorocolina) se considera una modalidad de imagen de segunda línea adecuada para permitir paratiroidectomía mínimamente invasiva.
Existe controversia sobre cuál es la técnica de extirpación más adecuada: paratiroidectomía total, subtotal o total con autotrasplante. Actualmente la más utilizada es la paratiroidectomía subtotal porque es la que suele presentar menor índice de recidivas poscirugía, aunque depende en gran parte de la experiencia del equipo quirúrgico de cada centro.
Se desaconseja dejar como tejido residual (en caso de paratiroidectomía subtotal o para uso como autotrasplante) una glándula hipercaptante en la gammagrafía.
Se debe recordar, no obstante, que la paratiroidectomía no está exenta de complicaciones177, con un aumento de mortalidad precoz y aumento de las tasas de hospitalización durante el primer año, aunque con buenos resultados a largo plazo en estudios observacionales178. Se debe monitorizar adecuadamente la aparición de síndrome de hueso hambriento (> 25% de los pacientes), con un nadir entre la semana 1 y 3 postoperatorias. Los factores de riesgo son la edad < 45 años, calcio postoperatorio < 8,4 mg/dL o niveles de fosfatasa alcalina > 120 U/L, entre otros178,179. Su tratamiento requiere dosis elevadas de calcio oral y endovenoso, calcitriol y calcio en el baño elevado temporalmente (una de sus pocas indicaciones)178,179. Se ha sugerido que el uso de bisfosfonatos previo a la paratiroidectomía podría minimizar la severidad del síndrome de hueso hambriento179,180.
Fármacos antirresortivos/osteoformadores
Bisfosfonatos
En los diferentes estudios realizados en población general se han incluido pacientes con deterioro de función renal, habiéndose observado, en análisis post hoc, mejoría de la DMO y disminución del riesgo de fracturas, independientemente de la función renal4,181. De este modo, se han descrito estos beneficios con el tratamiento con alendronato, risendronato, denosumab (y también con el modulador selectivo de receptores estrogénicos, raloxifeno) en pacientes (mujeres con osteoporosis) con ERC estadio 1-4 (con creatinina aparentemente normal o < 1,6 mg/dL), sin diagnóstico previo conocido de ERC, pero típicamente con valores normales de calcio, fósforo, PTH y fosfatasa alcalina4,181.
Asimismo, en los pocos estudios publicados de pacientes en diálisis también se ha observado mejoría de la DMO, sobre todo cuando los pacientes presentaban PTH elevada182. No obstante, se debe tener en cuenta que, según ficha técnica, los bisfosfonatos no están recomendados por falta de experiencia para aclaramientos de creatinina < 35-30 mL/min, aunque se han usado con éxito en pacientes afectos de calcifilaxis182. Por otro lado, y en contra de lo que se podría esperar, no está claramente demostrado que los bisfosfonatos sean causa de enfermedad ósea adinámica4,63.
Si bien se han descrito muy pocos efectos negativos sobre el riñón con la administración endovenosa, es importante alargar el tiempo de infusión, disminuir dosis a la mitad y limitar el tiempo de exposición (por ejemplo, dos años) para evitar efectos secundarios. Se han descrito casos de necrosis tubular, nefritis intersticial y glomerulosclerosis focal con síndrome nefrótico. La administración oral no parece alterar la función renal.
Mención especial merece la osteonecrosis de mandíbula que se ha relacionado en los últimos años con el tratamiento con agentes antirresortivos, si bien su incidencia es muy baja. Esta lesión se define como la presencia de una o varias lesiones ulceradas con exposición ósea en el maxilar superior y/o la mandíbula de más de ocho semanas de evolución. Es excepcional que se presente con los bisfosfonatos orales. Los factores de riesgo incluyen la administración de bisfosfonatos endovenosos durante largo periodo de tiempo, neoplasias, quimioterapia, radioterapia, altas dosis de esteroides, abuso de alcohol y/o tabaco, y sobre todo, factores locales como patología periodontal, extracción dental y cirugía máxilo-facial, motivo por el que se recomienda buena higiene bucal y suspensión transitoria de estos fármacos ante la eventualidad de precisar dichos tratamientos, previa valoración del riesgo/beneficio (suspensión solo si el riesgo de fractura es relativamente bajo). También se ha descrito la fractura atípica (diafisaria) femoral. Es posible que los beneficios de disminuir un elevado riesgo de fractura y mortalidad asociada justifiquen el bajo riesgo de estas complicaciones muy poco frecuentes.
Denosumab
El denosumab es un anticuerpo monoclonal humanizado con una gran afinidad y especificidad frente al receptor activador del factor nuclear kappa B (RANKL) que se administra por vía subcutánea cada seis meses. Al inhibir la proliferación y la actividad de los osteoclastos, el denosumab disminuye la resorción ósea y consecuentemente aumenta la DMO y reduce el riesgo de fracturas183. No se elimina por el riñón, lo cual puede ser una ventaja en el paciente con ERC puesto que no existe una restricción directa en pacientes con disminución del filtrado glomerular, ya que no necesita corrección de dosis. Sin embargo, puede ocasionar hipocalcemia severa, especialmente en pacientes con ERC, empeoramiento transitorio del HPTS y se han descrito rebotes de pérdida ósea tras su suspensión184.
Aunque no existen pruebas concluyentes, ambos agentes antirresortivos (bisfosfonatos, denosumab) podrían exacerbar una enfermedad ósea adinámica, o simplemente no ser efectivos. Por otra parte, es probable que se deba considerar con los bisfosfonatos la posibilidad de «vacaciones terapéuticas» que no estarían indicadas con denosumab, dado que un análisis post hoc reciente ha mostrado que los beneficios de denosumab se pierden rápidamente y se incrementa el riesgo de fracturas185. Estaría indicado el uso de «terapias secuenciales» con estos agentes. Cada vez existe más experiencia sobre su uso prolongado en pacientes con persistencia de alto riesgo de fractura o con osteoporosis inducida por corticoides186–188.
En cuanto al riesgo de osteonecrosis de mandíbula y fractura atípica femoral, podrían aplicarse los mismos principios mencionados con los bisfosfonatos.
Teriparatida
La teriparatida es un fragmento de la PTH humana constituido por los 34 primeros aminoácidos a contar desde el extremo N-terminal. El péptido interactúa con el receptor tipo 1 de la PTH, que se localiza principalmente en los osteoblastos y en las células de los túbulos renales. La terapia intermitente con teriparatida incrementa el número de osteoblastos y la consiguiente formación de hueso (efecto anabólico), mediado por la disminución de la apoptosis osteoblástica y el aumento de la activación de los osteoblastos y de los preosteoblastos. Podría tener indicación en la EOA, pero su uso está limitado a dos años por el riego de osteosarcoma189.
Tratamiento por estadios
Estadios 1-2
Tanto las guías KDOQI como las KDIGO no recomiendan ningún tratamiento en estadios 1-2 de la ERC. Sin embargo, si queremos ser coherentes con los datos obtenidos de varios estudios, podríamos poner en marcha estrategias no de tratamiento, pero sí de prevención.
Dieta
Es conocido que pacientes con discreta pérdida de la función renal ya presentan retención de fósforo, con descensos no detectables del calcio total y aumento de PTH si son sometidos a una sobrecarga de fósforo, por lo que comenzar con una discreta restricción de fósforo parece adecuado.
Por otro lado, el paciente estará más receptivo a someterse a una dieta cuando se le acaba de diagnosticar una enfermedad renal que cuando el diagnóstico se ha realizado tiempo atrás y nadie le ha hablado de dieta.
La dieta podría comenzarse con una ingesta de 0,8 g de proteínas/peso corporal ideal/día (nueva recomendación de la OMS para la población general); esto condicionaría dos beneficios, por un lado, una disminución del aporte de fósforo y un menor estímulo para la PTH y FGF23, y por otro, una disminución de los efectos perjudiciales de la hiperfiltración glomerular190–192. Hay que tener también en cuenta que, en general, el grado de evidencia presentado en distintas guías de ERC es variable 4,107.
25(OH)D3 (calcidiol)
Se sugiere la medición de los niveles de calcidiol en pacientes con ERC a partir del estadio 3 o en pacientes que, por el motivo que fuere, se diagnostican de HPTS. La deficiencia o insuficiencia de vitamina D se debería reponer siguiendo las estrategias recomendadas en la población general110. Se considera que nivel aconsejado debería ser > 20 ng/mL para cubrir las necesidades diarias del 97,5% de la población o de 30 ng/mL para evitar aumento de los niveles de PTHi110,193.
Las dosis precisas no están bien definidas. Los ensayos clínicos en población general han usado dosis de 300 a 800 UI/día, considerándose actualmente un máximo de 4.000 UI/día110.
En España no disponemos de farmacopea para vitamina D2 (ergocalciferol), excepto en preparados multivitamínicos. Por otra parte, disponemos de vitamina D3 (colecalciferol) en forma de gotas (en frascos de 10 mL = 20.000 UI/frasco = 2.000 U/mL = 30 gotas; 1 gota = 67 UI) o incluso en viales monodosis de 25.000 UI (para administrar habitualmente de modo mensual –830 UI/día– o quincenal). Aunque se debe individualizar su dosificación, en general dosis de colecalciferol inferiores a 600-800 UI/día (por ejemplo, 9-12 gotas) suelen resultar ineficaces. Existen también varios preparados que contienen 200-800 UI de vitamina D3 + diversas cantidades de calcio. Se recomienda ser prudente con el uso de estas asociaciones, especialmente en pacientes con calcificaciones vasculares o riesgo de padecerlas.
Otra posibilidad más cómoda es el empleo de calcifediol (ampollas o capsulas de 0,266 mg = 266 μg = 16.000 UI de 25-(OH) vitamina D generalmente mensual y excepcionalmente y con mayor control quincenal, durante periodos cortos, existiendo también una presentación en gotas, en frascos de 10 y 20 mL, donde una gota = 240 UI). Se debe prestar atención en pacientes obesos al tratarse de una vitamina liposoluble.
La potencia de calcifediol (μg a μg) parece ser unas cinco veces superior a la del colecalciferol194 y su vida media es más prolongada. La administración de calcifediol con periodicidad mensual (excepcionalmente quincenal), con los controles mencionados de los niveles de calcidiol, creatinina, calcio y fósforo, es una alternativa cómoda para adecuar los aportes nutricionales en los pacientes con ERC u osteoporosis195. Para pacientes con ERC estadios 3-4 con HPS y déficit de vitamina D se ha comercializado ya en algunos países una formulación con liberación extendida/prolongada de calcifediol196.
Calcio
Una cantidad entre 15-20 mg/kg/día en la dieta sería suficiente para asegurar la cobertura de necesidades de dicho elemento. La cantidad recomendada diaria en la población general varía según edad y sexo entre 1.000 y 1.300 mg/día110. No es conocido si estas cantidades debieran limitarse en pacientes con calcificaciones vasculares.
Agentes antirresortivos
Hoy en día existen muy pocos datos en pacientes con ERC, lo cual podríamos considerar paradójico, especialmente si consideramos que este tipo de pacientes presentan un mayor riesgo de fracturas que la población general. Sin embargo, en pacientes con ERC estadios 1-2 y con osteoporosis y/o alto riesgo de fractura, según los criterios de la OMS, se recomienda actualmente el mismo manejo que en la población general4.
Estadio 3 (fig. 5)
Duranteeste periodo se suele observar ascenso de los valores de PTH que comienzan a dibujar un incremento exponencial. Las recomendaciones cambian respecto las anteriores etapas y no existe uniformidad de opinión entre las distintas guías4,107.
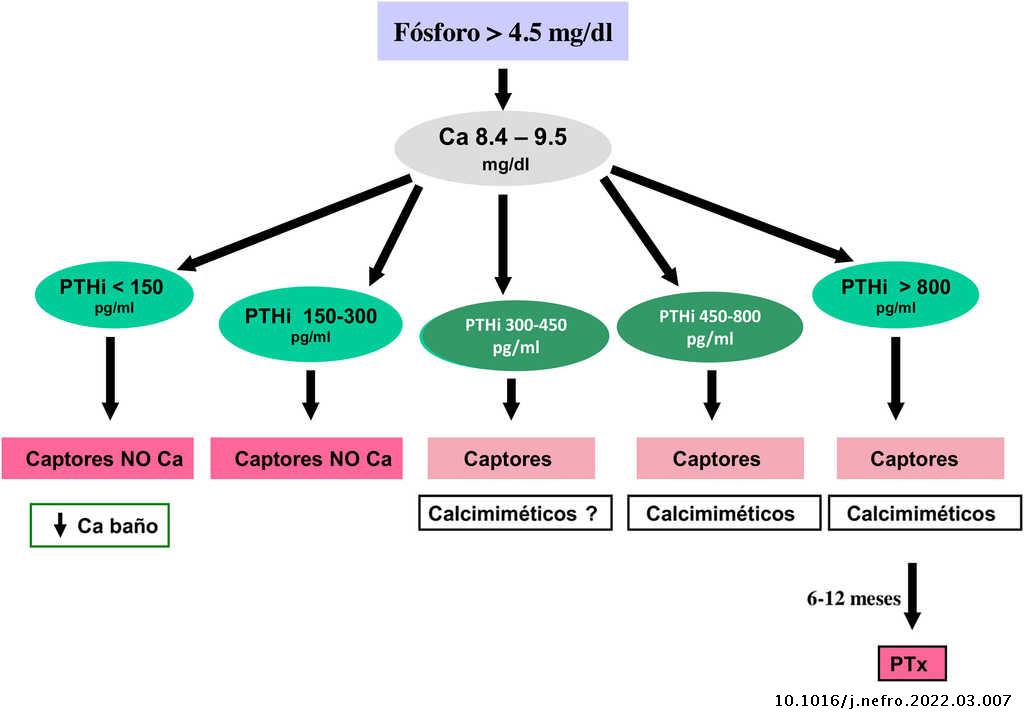
Dieta
La restricción proteica buscará evitar el aporte de fósforo y la hiperfiltración, pero con monitorización adecuada para evitar malnutrición. El paciente tolerará fácilmente el cambio si ya se había adecuado a la dieta desde los estadios anteriores.
Algunos autores solo limitan productos con contenido desproporcionado en fósforo respecto al contenido proteico (abuso de lácteos, sodas y especialmente productos preparados con aditivos), pues muchos pacientes pierden apetito de un modo espontáneo hacia las proteínas a medida que avanza la enfermedad renal.
25(OH)D3 (calcidiol)
Los valores de 25(OH)D3 se seguirán vigilando para asegurarse de que sean normales con colecalciferol o calcifediol en sus distintas formas si se precisa110.
Captores de fósforo
Con este grado de función renal y la intervención dietética no es difícil mantener una fosfatemia normal al menos hasta estadios 3b avanzados. Si no fuera así, se puede comenzar con captores de fósforo con las comidas, aunque especialmente los captores cálcicos se deberían usar con prudencia en pacientes con calcificaciones vasculares.
Metabolitos activos de la vitamina D
La dosis sugerida inicial de calcitriol en caso de aumento progresivo y significativo de los niveles de PTHi es de 0,25 μg dos a tres veces por semana o cada 48 h, y la de α-calcidol de 0,25 μg cada 24-48 h197. Estas dosis deben ajustarse con controles bioquímicos periódicos sin intentar normalizar los niveles de PTH por los motivos adaptativos explicados con anterioridad. Quizás sea recomendable darlo por la noche porque va seguido de ocho horas de ayuno y así tiene menos efecto sobre la absorción intestinal de calcio.
La dosis sugerida de paricalcitol en este estadio es de 1 mcg doa a tres veces por semana o cada 48 horas según los niveles de PTHi. Esta dosis debería ajustarse con controles bioquímicos periódicos. La conversión a paricalcitol suele seguir una relación 1 mcg de paricalcitol ≈ 0,25 mcg de calcitriol ≈ 0,50 α-calcidol.
Agentes antirresortivos
En pacientes con ERC 3a-3b con PTH en el rango normal y osteoporosis y/o alto riesgo de fractura, según criterios de la OMS, se sugiere tratamiento como en la población general 4,198. Hay que sopesar con cuidado la indicación de bisfosfonatos o denosumab en casos con sospecha de EOA. En pacientes con ERC 3a en adelante (3a-5D) con anormalidades bioquímicas del complejo CKD-MBD y DMO disminuida y/o fracturas por fragilidad, se sugiere que las opciones de tratamiento tengan en cuenta la magnitud y reversibilidad de las anormalidades bioquímicas y la progresión de la ERC, considerando la posibilidad (no mandatoria) de una biopsia ósea 4,91,198.
ESTADIO 4 (fig. 6)
En estafase, la elevación del valor de PTH es importante y más rápida, por lo que se debe ser más estricto en dieta y tratamiento.
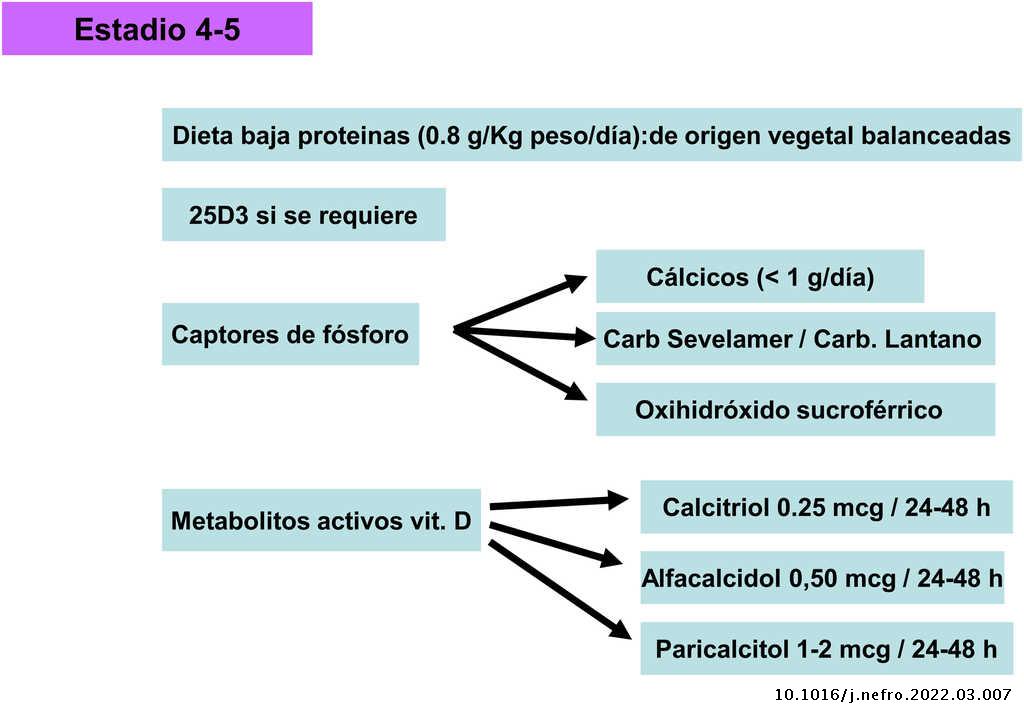
Dieta
La restricción proteica será discretamente más importante (máximo 0,8 g/kg de peso/día) pero solo si puede asegurarse una adecuada nutrición.
25(OH)D3 (calcidiol)
Los valores de 25(OH)D3 se seguirán vigilando para asegurarse de que sean normales con colecalciferol o calcifediol en sus distintas formas si se requiere.
Captores de fósforo
Con este grado de función renal, comienza a ser algo difícil mantener una fosfatemia normal a pesar de la dieta. En caso de aumento progresivo y persistente del fósforo por encima de los niveles normales se deberían incrementar las medidas de restricción de fosfato y/o utilizar una mayor dosis de captores con las comidas, que, si son con contenido cálcico, no deberían sobrepasar en ningún caso los 1.000 mg/día. Debemos recordar de todos modos que las guías KDIGO 20174 sugieren restringir las dosis de captores basados en calcio en adultos desde el estadio de ERC 3a, habiendo aumentado el grado de evidencia respecto a las guías anteriores, a pesar de las limitaciones en las fichas técnicas para carbonato de lantano y carbonato de sevelámer. Curiosamente, y aceptado en ficha técnica, se podría utilizar hidróxido de aluminio (si estuviera disponible) durante un periodo corto, administrándolo solo en las comidas cuyo contenido en fósforo lo justifique. Existe experiencia con el uso de oxihidróxido sucroférrico antes de iniciar la diálisis.
Metabolitos activos y análogos de la vitamina D
En este estadio, según los niveles de PTH, la dosis inicial recomendada de calcitriol es de 0,25-0,50 mcg cada 24-48 horas. Estas dosis deberían ajustarse con controles bioquímicos periódicos. El menor efecto sobre la absorción de calcio y fósforo del paricalcitol, así como su potencial menor efecto sobre las calcificaciones cardiovasculares, puede hacer recomendable su uso en este estadio, especialmente intentando evitar las dosis elevadas de calcitriol o α-calcidol.
La dosis inicial sugerida de paricalcitol en este estadio es de 1 mcg cada 24-48 horas. Esta dosis debería ajustarse con controles bioquímicos periódicos.
Agentes antirresortivos
Como se ha mencionado con anterioridad, en pacientes con ERC 3a en adelante (3a-5D) con anormalidades bioquímicas del complejo CKD-MBD y DMO disminuida y/o fracturas por fragilidad, se sugiere que las opciones de tratamiento tengan en cuenta la magnitud y reversibilidad de las anormalidades bioquímicas y la progresión de la ERC, considerando la posibilidad (no mandatoria) de una biopsia ósea. De plantearse tratamiento con agentes antirresortivos por la existencia de un elevado riesgo de fractura en pacientes con aclaramientos de creatinina < 30 mL/min y con control adecuado de las alteraciones bioquímicas propias de la ERC, debería plantearse la posibilidad de tratar con fármacos que no poseen eliminación renal, como denosumab, siguiendo las advertencias mencionadas con anterioridad111,199. El uso de bisfosfonatos no está estrictamente contraindicado, pero no están recomendados por falta de experiencia.
ESTADIO 5 (fig. 6)
En esta fase, el control del HPTS es más difícil. La función renal está severamente deteriorada y tanto la función excretora como las endocrinas son deficientes, la variabilidad bioquímica es grande y la situación puede variar en poco tiempo, por lo que el tratamiento es más difícil de estandarizar. Si el paciente ha sido controlado desde estadios precoces, generalmente la pauta del estadio anterior es suficiente.
Dieta
La restricción proteica deberá mantenerse, cuidando no comprometer una adecuada nutrición.
25(OH)D3 (calcidiol)
Los valores de calcidiol se seguirán vigilando, para continuar asegurándonos de que sean al menos superiores a 20 ng/mL con colecalciferol o calcifediol.
Captores de fósforo
Con este grado de función renal es muy difícil mantener una fosfatemia normal si no se administran captores de fósforo con las comidas. La pauta es la misma que en el estadio anterior, con dosis habitualmente más elevadas, aconsejándose una mayor restricción de captores con calcio.
Metabolitos activos de la vitamina D
En este estadio, las dosis recomendadas son las mismas que en el anterior, aunque se podrán modificar en función de la calcemia, fosfatemia y valores séricos de PTH. La dosis inicial sugerida de paricalcitol en este estadio, a modo de orientación, es de 1 μg cada 24 horas si la PTHi es inferior a 500 pg/mL e incluso de 1-2 μg cada 24 horas si la PTHi es superior a 500 pg/mL, también modificable en función de calcemia y fosfatemia.
ESTADIO 5D (DIÁLISIS) (fig. 7)
Control del fosfato
El incremento de los niveles séricos de fosfato es uno de los principales problemas que presentan los pacientes con ERC en tratamiento con diálisis. Evitar la hiperfosfatemia tiene dos objetivos: uno, conseguir un adecuado control del metabolismo óseo-mineral, preferentemente para evitar el desarrollo y las complicaciones del HPTS, y otro, reducir el riesgo cardiovascular y la alta tasa de morbi-mortalidad de estos pacientes. La asociación independiente entre hiperfosfatemia y mortalidad ha sido demostrada con el análisis retrospectivo de varias amplias bases de datos. Más recientemente, el estudio COSMOS ha mostrado una reducción significativa del riesgo de mortalidad asociada a los descensos de fósforo sérico52. Por tanto, mantener el fósforo dentro de la normalidad (por ejemplo: < 4,5 mg/dL), con medidas razonables, se ha convertido en un objetivo prioritario. Este estudio en pacientes en diálisis muestra que la menor mortalidad se observa con 4,4 mg/dL (intervalo 3,6-5,2) y, en un análisis del «Dialysis Outcomes and Practice Patterns Study» (DOPPS), la supervivencia de los pacientes mejoraba cuanto menor era el número de valores que no excedieran 4,5 mg/dL durante un período de seis meses200. Asimismo, el área bajo la curva de fósforo de los pacientes (con medidas seriadas, tal y como recomiendan las KDIGO) fue también un mejor predictor de muerte cardiovascular que el nivel de fósforo sérico más reciente200. Por otra parte, los fenotipos asociados a niveles de fósforo mayores de 5 mg/dL (alto fósforo) se asociaron a una mayor tasa de mortalidad y hospitalización, independientemente de los fenotipos de calcio y PTH (alto, normal o bajo)201.
En este caso, el tratamiento de la hiperfosfatemia se basa en tres pilares fundamentales:
a) Restricción de la ingesta dietética de alimentos con alto contenido en fósforo sin comprometer la ingesta básica de proteínas.
b) Modificaciones de las características y esquema de diálisis para optimizar la eliminación de este soluto.
c) Administración de captores del fósforo.
d) En la mayoría de los casos, se requiere una combinación de estas tres alternativas terapéuticas.
Dieta
En hemodiálisis, los requerimientos proteico-energéticos deben ser superiores a los recomendados para la población general, dada la condición catabólica de la técnica y la propia enfermedad. Lógicamente, también son superiores a las recomendadas en el enfermo con ERC aún no en diálisis.
Lo primero debe ser garantizar un adecuado soporte calórico, proteico y mineral. Nunca el precio a pagar por una dieta presuntamente adecuada debe ser la nutrición insuficiente. El sentido común marca las normas de una dieta equilibrada. Cuatro comidas al menos y balanceadas en cuanto a los principios inmediatos (hidratos de carbono, grasas y proteínas). Un metaanálisis reciente demuestra que la dieta (y, entre otros, 20-30 minutos/mes de terapia por un dietista) puede reducir los niveles de fósforo sin comprometer la nutrición, pero la calidad de la evidencia es baja y probablemente la terapia será ineficaz si no se mantiene202.
Se considera que la ingesta óptima de proteínas debe ser de 1-1,2 g/kg/día (de las cuales el 50% deben ser de alto valor biológico, es decir proteínas animales), y la calórica de 30-35 kcal/kg de peso (35 para menores y 30 para mayores de 65 años). En diálisis peritoneal la recomendación incluso es mayor (1,2-1,3 g/kg de peso/día).
Esta mayor liberación de la dieta proteica puede ocasionar un efecto adverso en la entrada de fósforo. Es decir, el precio a pagar por asegurar los requerimientos proteicos mínimos podría ser la necesidad de mayores dosis de captores intestinales del fósforo.
Diálisis
La duración idónea de la sesión de diálisis es un tema muy controvertido. Actualmente, se considera que la duración de la diálisis debe individualizarse de acuerdo a los requerimientos de cada paciente. Sin embargo, no hay evidencia clara de que exista un efecto independiente del tiempo de diálisis sobre el control del fósforo, exceptuando pacientes con una elevada función renal residual. En términos generales, un incremento del tiempo y/o la frecuencia de la diálisis mejoran la eliminación de solutos.
- El tiempo de duración de la sesión de diálisis puede ser determinante en la eliminación de pequeños solutos, que están principalmente localizados en el espacio intracelular, como es el caso del fósforo.
No existen estudios prospectivos, controlados y aleatorizados que confirmen de forma definitiva que un incremento del tiempo de diálisis tenga un efecto sobre el control de la hiperfosfatemia. Sin embargo, la mayoría de los estudios publicados describen un efecto beneficioso del aumento de la duración de la sesión de hemodiálisis y/o hemodiálisis nocturna intermitente sobre la eliminación de fósforo203.
- Incrementar la frecuencia de las sesiones de hemodiálisis es otra alternativa. Tampoco hay estudios adecuados para valorar el efecto del incremento de la frecuencia sobre el aclaramiento del fósforo. La mayoría de estos trabajos son estudios observacionales, con un escaso número de pacientes seleccionados, seguidos por un corto espacio de tiempo.
Para lograr una reducción significativa de los niveles de fósforo sérico actualmente existe una tendencia a aumentar la frecuencia (en horas totales) de la hemodiálisis con esquemas de 2,5-3,0 horas cinco a seis veces por semana204,205. Como se ha mencionado, el incremento de ambos parámetros, tiempo y frecuencia, puede ser un procedimiento eficaz para el tratamiento de la hiperfosfatemia refractaria. Con la diálisis larga nocturna diaria (cinco a seis sesiones de 6-10 horas de duración) existe una marcada disminución de los niveles de fosforo, con una reducción de las dosis de captores del fósforo (o incluso la necesidad de añadir fosfato al baño de diálisis), aun a pesar de haberse objetivado que los pacientes incrementan la ingesta diaria de fósforo205.
- Técnicas con alto transporte convectivo. Su empleo puede ser considerado como una alternativa terapéutica de la hiperfosfatemia. Las membranas de alto flujo tienen una mayor capacidad de eliminación de fósforo que las de bajo flujo. No obstante, actualmente tampoco hay una evidencia clara de las ventajas potenciales de las nuevas membranas ni de la hemodiafiltración a este respecto.
Captores de fósforo
Como ya se ha mencionado, la mayoría de los pacientes en hemodiálisis presentan un balance positivo de fósforo, por lo que van a requerir un tratamiento adicional con captores intestinales de fósforo para evitar la hiperfosfatemia. Las limitaciones potenciales de los captores cálcicos (asociados o no a magnesio) e hidróxido de aluminio son las mismas que en estadios anteriores, habiéndose sugerido la restricción de los captores con calcio en adultos y recomendado evitar el uso de captores con aluminio (además de evitar la contaminación del líquido de diálisis con aluminio)4. Existe una amplia experiencia tanto con sevelámer como con carbonato de lantano y menor con oxihidróxido sucroférrico, aunque con resultados esperanzadores con este último por el bajo número de comprimidos necesarios para controlar el fósforo sérico. Un nuevo ensayo clínico reciente muestra cómo un control estricto (vs. 5,0-6,0 mg/dL) de fósforo plasmático con carbonato de lantano u oxihidróxido sucroférrico podría retrasar la progresión de la calcificación coronaria en estos pacientes206, mientras que en otro ensayo cuyo objetivo era mantener el fósforo plasmático entre 3,5-6,0 mg/dL no se apreciaron diferencias en eventos cardiovasculares entre carbonato de lantano y calcio207.
Control del calcio
Actualmente, como recomendación general sobre los niveles de calcio, se considera que el objetivo es evitar la hipercalcemia (habitualmente > 9,5 mg/dL). Un estudio europeo en pacientes en diálisis52 mostró que la menor mortalidad se encontraba con niveles de calcio entre 7,9-9,5 mg/dL.
De manera especial, se debería evitar la asociación de niveles elevados de calcio con PTH baja, así como la asociación de niveles elevados de calcio y fósforo, combinaciones que se han relacionado con aumentos de mortalidad en pacientes en diálisis o con la presencia de calcificaciones vasculares. Como se ha mencionado con anterioridad, un cierto grado de hipocalcemia (asintomática) inducida por calcimiméticos actualmente se considera tolerable y podría ser incluso beneficiosa, no debiéndose instaurar en este caso maniobras para su normalización. Además, con el calcio más bajo el FGF23 desciende, siempre que el P esté controlado208.
Dieta
El incremento proporcional de calcio con el aumento de las recomendaciones proteicas varía en función de la cantidad de lácteos. De forma orientativa, una dieta de 1-1,2 g/kg/día de proteínas ya contiene entre 550 y 950 mg de calcio.
La ingesta total de calcio elemento al día no debe exceder los 1.000 mg, incluyendo tanto el calcio de la dieta como el incluido en los captores del fósforo o resinas de intercambio iónico.
Diálisis
Ajustes en la concentración de calcio en el líquido de diálisis pueden contribuir a optimizar el balance de calcio en estos enfermos. No existe un consenso sobre cuál debe ser el contenido de calcio en el líquido de diálisis. Valores de 1,25 mM (2,5 mEq/l; 5 mg/dL) se han asociado con un balance negativo de calcio y tendencia al incremento de la PTH. Además, con 1,25 mM podría existir una peor tolerancia hemodinámica a la ultrafiltración, que se potencia si el contenido de magnesio no es adecuado. Niveles más elevados, 1,75 mM (3,5 mEq/l; 7 mg/dL) frenan la secreción de PTH, pero producen un balance positivo de calcio y debiera reservarse solo para la hipocalcemia sintomática grave o el síndrome de hueso hambriento post-paratiroidectomía.
Siguiendo las KDIGO 20174, insistimos en que hay que evitar la hipercalcemia y no parece aconsejable el aumento persistente del calcio en el líquido de diálisis como respuesta a la hipocalcemia inducida por calciméticos. Además, no podemos olvidar la importancia del control del P en presencia de hipocalcemia. Por otro lado, en pacientes con PTH baja, el líquido de diálisis con Ca de 1,25 mmol/L (incluso de 1 mmol/L) puede estar indicado para estimular la secreción de PTH y evitar la EOA, aunque las concentraciones bajas de calcio en el baño pueden predisponer a arritmias e inestabilidad hemodinámica.
Si es posible, se debe individualizar el contenido de calcio en el líquido de diálisis según las características de cada paciente y la evolución de su PTH209.
Teniendo en cuenta todos los factores mencionados, la concentración recomendable que, en líneas generales, mejor se adapta a las necesidades en situación de normocalcemia y PTH controlada es la de 1,5 mmol/L (3 mEq/L; 6 mg/dL), una prueba de la falta de consenso es que las guías KDIGO4 no han llegado a la misma conclusión y sugieren el uso de líquido en el baño entre 1,25 y 1,50 mmol/L (2,5-3 mEq/L). Se desconoce aún cuál es el balance de calcio según el líquido de diálisis en pacientes con hipocalcemia secundaria al uso de calcimiméticos. Todas estas consideraciones son aplicables a la diálisis peritoneal, donde es muy habitual y frecuentemente erróneo el uso de líquidos con contenido de calcio elevado en pacientes que ya tienen per se una mayor probabilidad de padecer una EOA y mayor tiempo de exposición al mismo210,211.
Control de la PTH
Se sugiere adoptar como objetivo inicial de PTHi valores séricos entre 150-300 pg/mL (aproximadamente 2X-5X) corregida para el kit usado. Cifras fuera de este rango de PTH se han asociado con un incremento de la morbi-mortalidad en los pacientes en hemodiálisis212–214, aconsejando evitar especialmente valores por debajo de 100-120 y por encima de 500-600 pg/mL como ya se mencionaba en las guías anteriores. Estos últimos valores coinciden aproximadamente con los valores considerados como «extremos de riesgo» expresados en las guías KDIGO (evitar valores < 2X y > 9X en relación con los límites superiores de la normalidad del kit usado para la medición de PTHi)3,4. Como se ha comentado con anterioridad, el reciente estudio COSMOS establece como punto de mayor supervivencia a nivel poblacional una PTH de 398 pg/mL52. Por ello mencionamos un objetivo terapéutico inicial de PTH entre 2X-5X-7X el límite superior de la normalidad para el kit empleado.
El grupo de trabajo considera que establecer como único margen de control de calidad adecuado unos valores < 2X y > 9X de los límites superiores de la normalidad del kit usado como sugieren las KDIGO es posiblemente inapropiado, puesto que llevaría indefectiblemente a que un número significativo de pacientes estarían fuera de estos rangos debido a la distribución gaussiana de las poblaciones. Estableciendo un objetivo terapéutico más estrecho como el sugerido («apuntar» inicialmente a 2X-5X), aseguraría que un mayor número de pacientes se encontrarían en el margen de seguridad lejos de los extremos de riesgo. Aceptar márgenes tan amplios208 puede también suponer no solo impactos negativos sobre la calidad ósea, sino también favorecer la progresión de la hiperplasia paratiroidea, disminuir la eficacia de las estrategias terapéuticas209 y dificultar además el control de la calcemia y fosfatemia215. Algo similar ocurre con el incremento de PTH antes del inicio de diálisis, pues este valor predice el descontrol del HPTS a los 12 meses de diálisis a pesar del uso de más fármacos antiparatiroideos160. El margen sugerido por las KDIGO se basa en estudios epidemiológicos que asocian estos valores extremos de PTHi con una mayor especificidad para el diagnóstico de enfermedad ósea de AR o BR, u otros que asocian dichos valores a mayor mortalidad214.
Para mantener este rango de PTH es prioritario tener bien controlados los niveles de calcio, fósforo y probablemente calcidiol séricos, idealmente desde la etapa prediálisis208. Si una vez logrado este objetivo persisten valores significativamente elevados o progresivamente crecientes de PTH (valorar tendencias crecientes aún dentro del rango entre 2X-9X) se sugiere el uso de metabolitos activos de la vitamina D, calcimiméticos o la combinación de ambos para disminuir la PTH. Debemos tener en cuenta que los fenotipos con PTH baja están asociados a un aumento de mortalidad independientemente de los fenotipos de calcio y fósforo (bajos, normales o altos)201. Sin embargo, es posible que esta asociación no sea debida al descenso farmacológico de PTH, sino a la enfermedad de base u otros factores asociados como edad, diabetes, malnutrición, estado inflamatorio, etc.63,216
Aunque el estudio EVOLVE no resultó significativo en su objetivo primario38, la mayoría de miembros de las KDIGO 2017 y de la SEN fueron reticentes a excluir beneficios potenciales de cinacalcet en pacientes con ERC 5D, basándose en una serie de resultados nominalmente significativos en análisis secundarios pre-especificados y estudios post hoc166,170,171,217,218. Sin embargo, no se considera que haya aún evidencia suficiente como para priorizar ningún agente anti-paratiroideo219 y que todos son aceptables como primera línea de tratamiento en pacientes en diálisis4.
También, aquí se considera razonable basar la terapia inicial en los niveles de calcio y fósforo216, así como otros aspectos de la CKD-MBD (por ejemplo, calcificación vascular), y que la dosis de captores del fósforo se ajuste para que los tratamientos para controlar la PTH no comprometan los niveles de calcio y fósforo.
25(OH)D3 (calcidiol)
Existen sugerencias que indican que en esta etapa también es necesario mantener niveles adecuados de calcidiol220,221. Ello podría ser útil para el control del HPTS, pero especialmente para otros efectos pleiotrópicos, auto- o paracrinos, de la vitamina D.
Metabolitos activos de la vitamina D
El tratamiento con metabolitos activos (calcitriol o α-calcidiol, paricalcitol) permite reducir los niveles de PTH, pero con frecuencia pueden conducir a una elevación del fósforo, calcio y producto calcio x fósforo y requieren un cuidadoso control. Todos los metabolitos activos se han asociado en estudios retrospectivos con aumentos de supervivencia de los pacientes en diálisis a pesar de aumentar los niveles de FGF-23. Una posible explicación es la demostración experimental de que el tratamiento con calcitriol, por ejemplo, atenúa la vía de señalización FGF-23/FGFR-4/calcineurina/NFAT responsable de la inducción de hipertrofia ventricular izquierda por FGF-2326,222, o que los activadores del RVD, particularmente paricalcitol, atenúan la fibrosis cardíaca, al menos parcialmente, mediante la regulación de microARNs223.
Se debe minimizar o suspender el tratamiento con metabolitos activos de vitamina D si se observan cifras elevadas de calcio y/o de fósforo no endógeno (ver siguiente parágrafo) o si la PTH equivalente es inferior a 100-150 pg/mL (o aproximadamente < 2X el límite superior de la normalidad para el kit usado). Ya hemos mencionado que el paricalcitol tiene menor efecto en la elevación de Ca, P y CaxP y, aunque desciende más rápidamente la PTH, este efecto tiene un valor secundario ya que la disminución de los niveles de PTH no constituye una urgencia médica. Algunos autores valoran la posibilidad de activar los RVD con bajas dosis de paricalcitol (por ejemplo, 1 ug/semana), aún con niveles bajos de PTH224,225, si es que no se usa vitamina D nativa en estas circunstancias. Todos los metabolitos activos de vitamina D se pueden administrar por vía oral o intravenosa a dosis que dependerán de los niveles séricos de PTH, y siempre y cuando los niveles de calcio y fósforo no endógeno estén controlados (por ejemplo, < 9,5 mg/dL y < 5 mg/dL, respectivamente). Ocasionalmente, en algunos casos de HPTS severo, los derivados de la vitamina D pueden descender el fósforo plasmático (fósforo endógeno procedente del hueso), pero en caso de hiperfosfatemia manifiesta sería preferible iniciar tratamiento con calcimiméticos para asociar posteriormente análogos de la vitamina D.
Calcimiméticos: cinacalcet y etelcalcetida
No debería iniciarse el tratamiento con calcimiméticos en pacientes en diálisis con una concentración sérica de calcio (corregida por la albúmina) por debajo del límite inferior del intervalo de normalidad (< 8,4 mg/dL). Si el paciente ya está en tratamiento con calcimiméticos, por debajo de este valor sí puede mantenerse el tratamiento si la situación clínica y la seguridad lo permiten.
En estos pacientes se podría considerar utilizar cinacalcet cuando la tendencia de PTH sea hacia el incremento, aunque no haya llegado a 300 pg/mL, siempre y cuando la calcemia y/o fosfatemia estén elevadas.
La dosis inicial recomendada para adultos es de 30 mg una vez al día, que deberá ajustarse cada dos a cuatro semanas sin superar la dosis máxima de 180 mg una vez al día. En caso de necesitar disminuir la dosis, se ha usado la administración del fármaco cada 48 horas. Otras dosis intermedias se consiguen con la administración de pautas diferentes (por ejemplo, 60 mg-30 mg a días alternos corresponderían a una dosificación de 45 mg/día).
Una alternativa terapéutica al cinacalcet para el control del hiperparatiroidismo es el tratamiento con etelcalcetida intravenoso, que además asegura cumplimiento terapéutico en pacientes no adherentes175. La dosis inicial recomendada de etelcalcetida es de 5 mg, administrados mediante inyección en bolo tres veces por semana (coincidente con las sesiones de hemodiálisis, al final de la sesión). El calcio sérico corregido se debe situar en el límite inferior del intervalo de normalidad o por encima de este antes de la administración de la primera dosis, de un aumento de la dosis o del reinicio después de una interrupción de la dosis. No se debe administrar con una frecuencia superior a tres veces por semana. La dosis de etelcalcetida se debe ajustar de forma individualizada entre 2,5 mg y 15 mg, de acuerdo con los niveles de PTH y calcio, mediante incrementos de 2,5 mg o 5 mg con una frecuencia no superior a cada cuatro semanas hasta una dosis máxima de 15 mg tres veces por semana para alcanzar el valor objetivo de PTH.
La extracción sanguínea para evaluar los niveles de PTH se han de evaluar al menos 12 horas después de la ingesta del fármaco.
En caso de producirse hipocalcemia significativa (por ejemplo, cifras inferiores a 7,5 mg/dL) se aconseja reducir la dosis y/o aumentar dosis de derivados de la vitamina D en caso de PTH aún elevada o si las medidas anteriores no son suficientes.
No se debe aumentar la concentración de calcio en el baño de diálisis para corregir la hipocalcemia a menos que sea sintomática.
Asociación de calcimiméticos y metabolitos activos de la vitamina D
Es posible que la asociación de metabolitos de la vitamina D y calcimiméticos pueda ser aditiva y/o sinergística en el control del hiperparatirodismo secundario quizá por su efecto sobrerregulador de los receptores19,20,226, o presentar otros efectos beneficiosos (por ejemplo, sobre la calcificación vascular)227. Se ha observado que el uso de calcimiméticos se ha asociado a una disminución de las necesidades de derivados de la vitamina D y viceversa. La combinación de tratamientos puede ayudar no solo a reducir dosis sino también efectos secundarios bioquímicos o clínicos 88,228, tal y como ocurre en el tratamiento combinado en la hipertensión arterial o en la inmunosupresión del trasplante renal.
En las siguientes gráficas (figs. 7, 8, 9, 10, 11 y 12) se muestra un algoritmo orientativo de manejo de las alteraciones bioquímicas del metabolismo óseo-mineral de pacientes en estadio 5D, en función de la PTHi o del fósforo sérico.
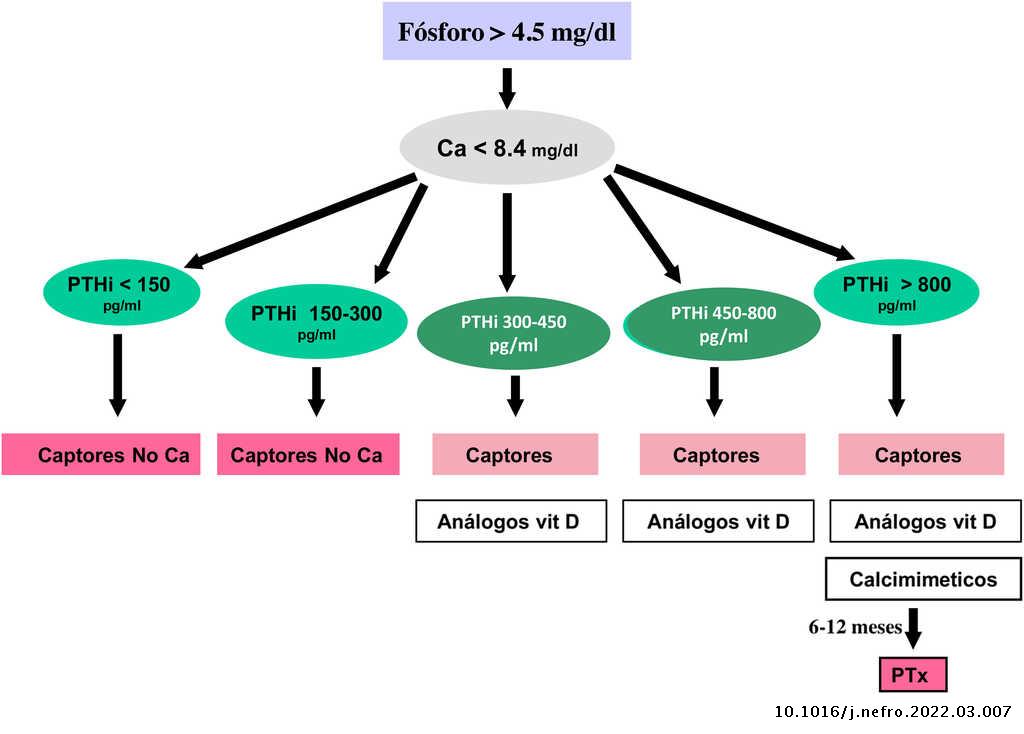
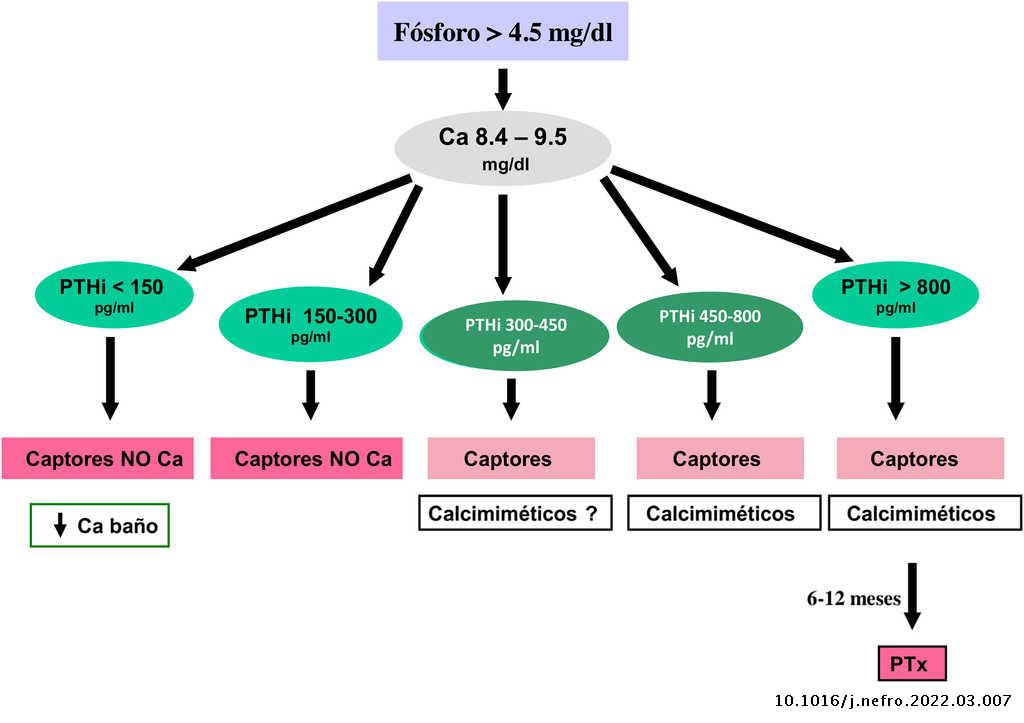
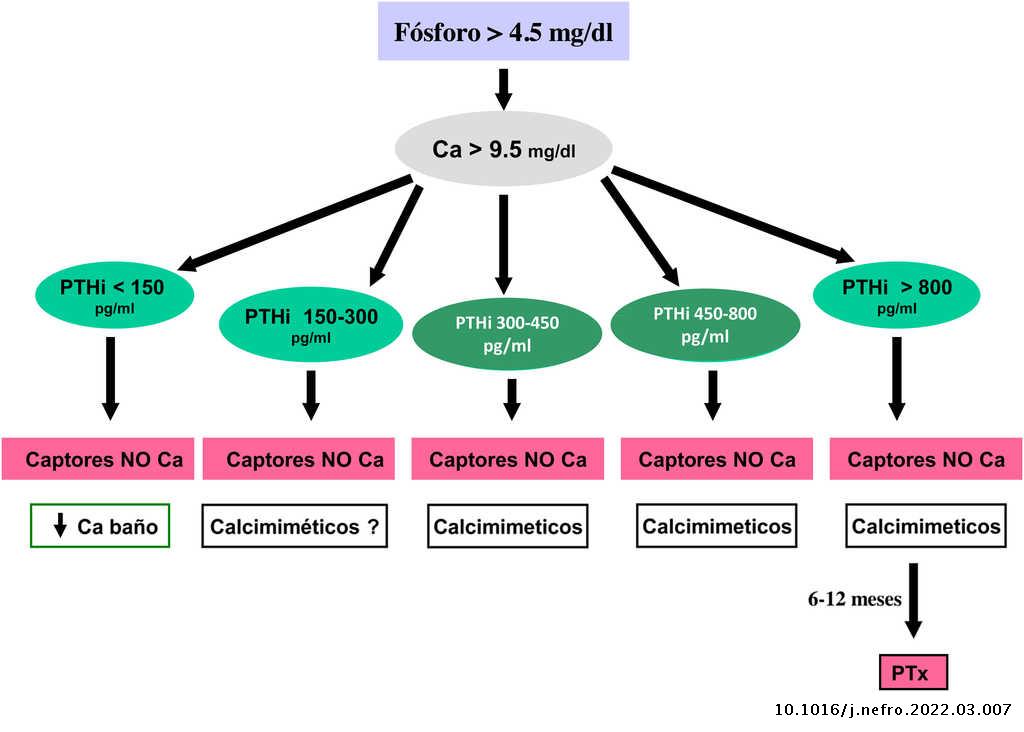
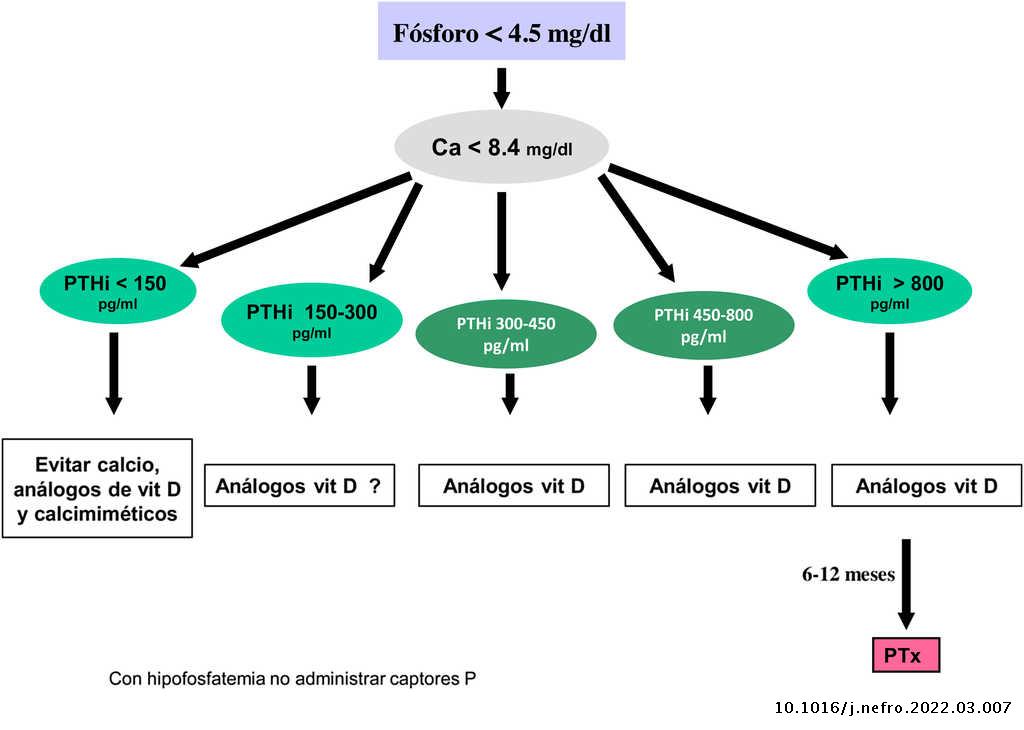
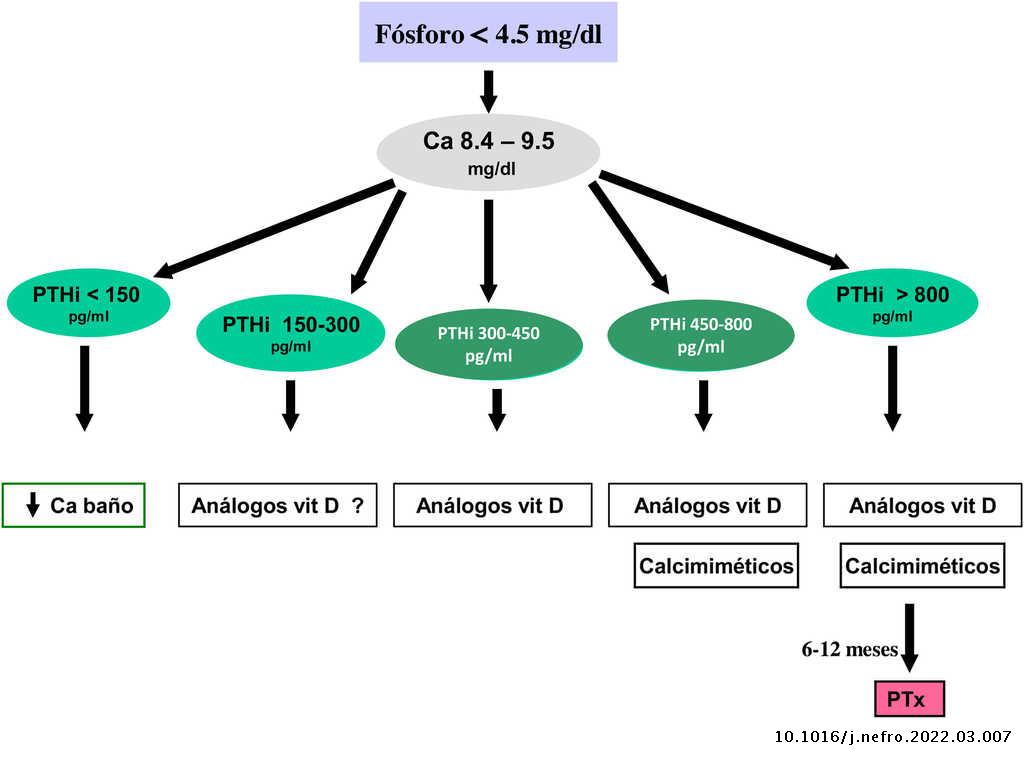
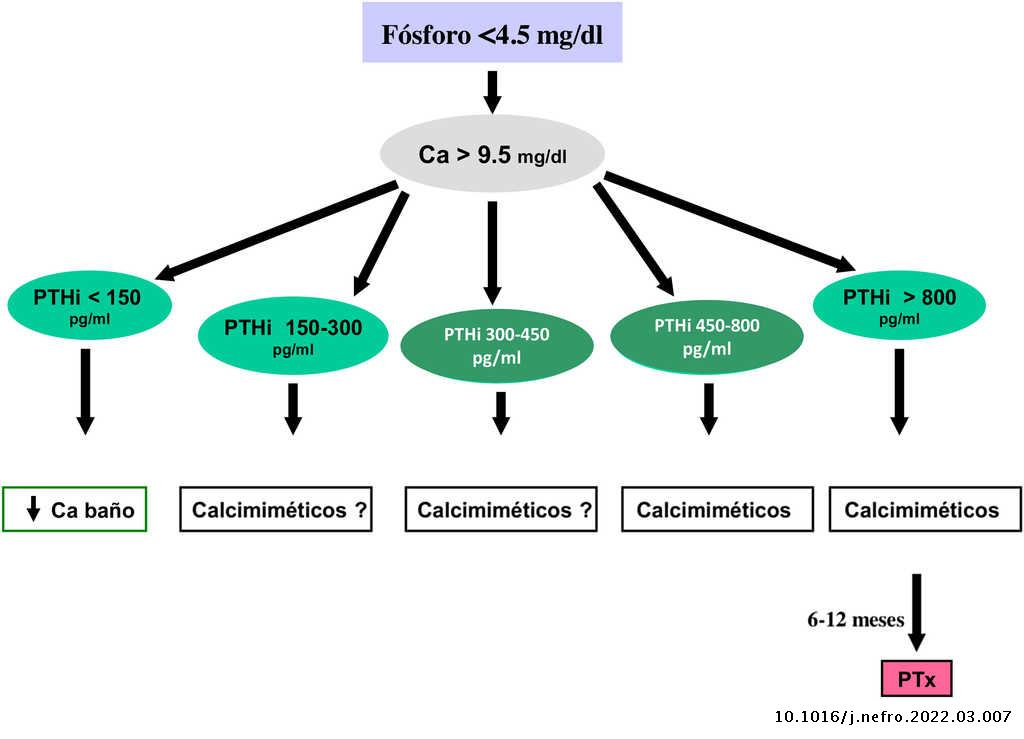
ESTADIO 5T (TRASPLANTE RENAL) (figs. 13-15)
Después del trasplante renal, es frecuente la persistencia del hiperparatiroidismo, tanto secundario (PTH elevada con calcio y fósforo normales) como terciario (PTH elevada con calcio alto, con o sin fósforo bajo), niveles elevados de FGF-23 y niveles bajos de vitamina D229. Además, los inmunosupresores, fundamentalmente los esteroides, tienen efectos nocivos sobre el hueso. A esto hay que añadir la persistencia de diferentes grados de insuficiencia renal, ocasionalmente acidosis y el efecto negativo sobre el balance de calcio del uso de diuréticos de asa. Todo ello se traduce, básicamente, en los siguientes problemas:
- Hiperparatiroidismo persistente.
- Pérdida de masa ósea y fracturas.
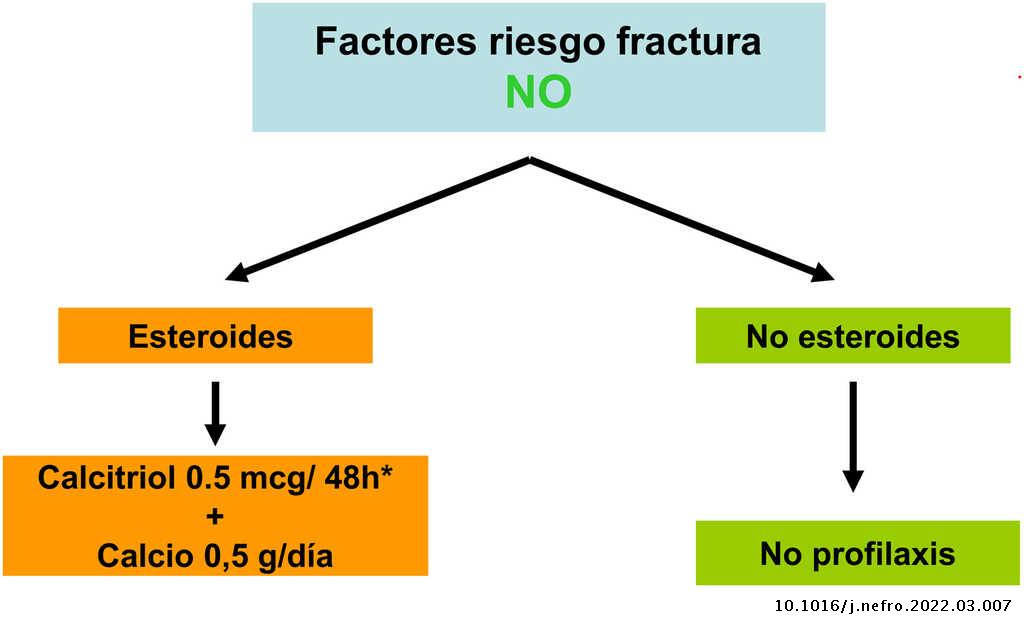
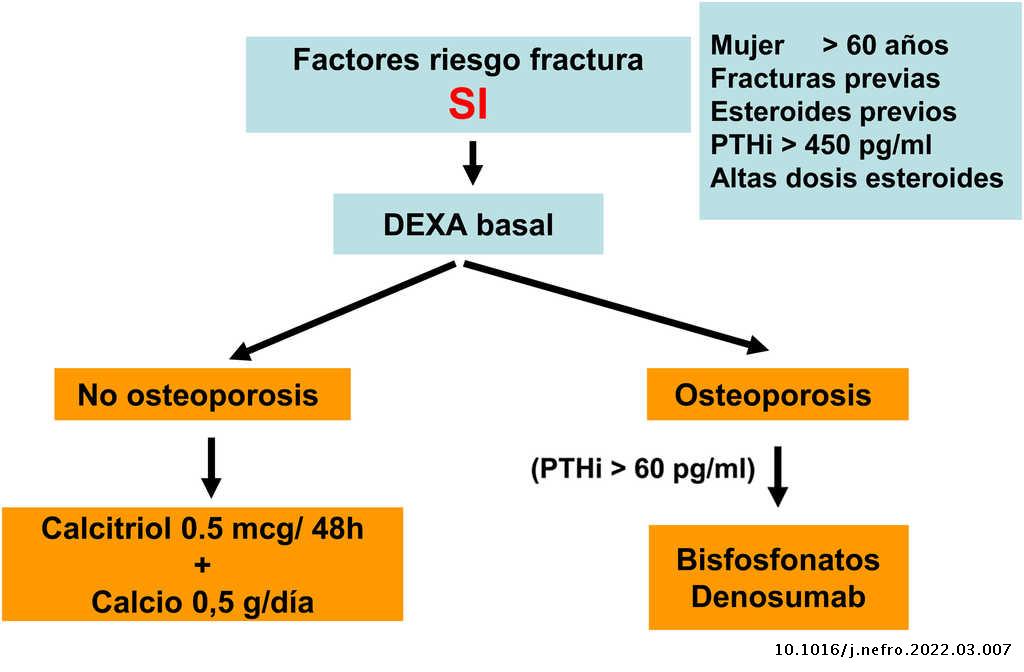
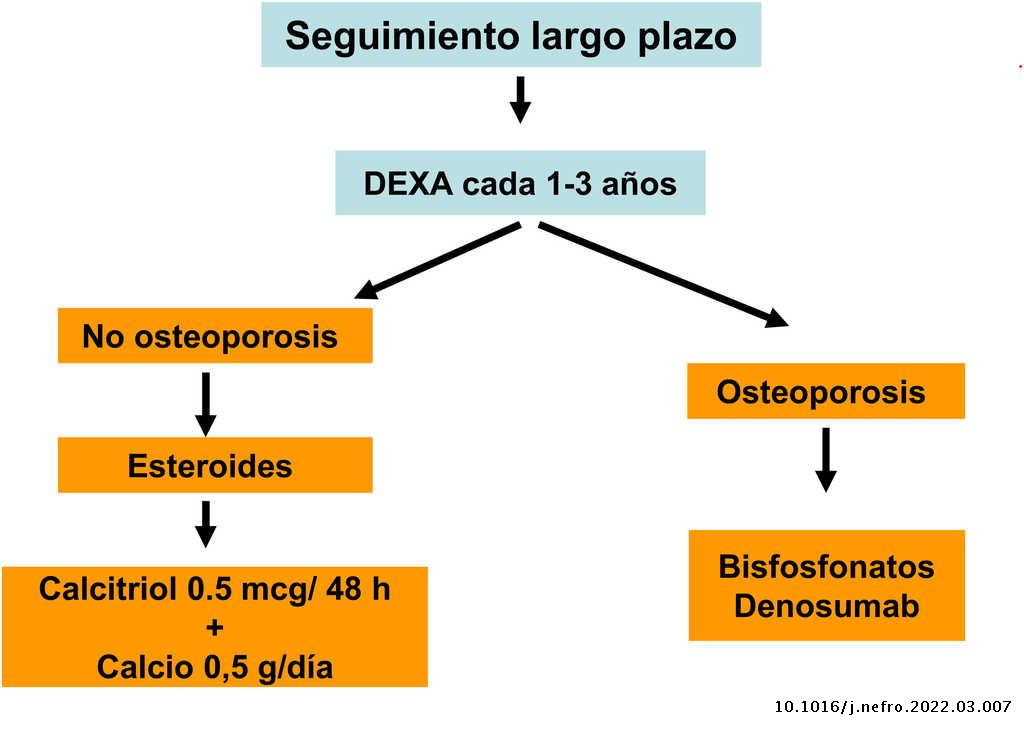
Hiperparatiroidismo persistente
El HPTS o terciario persistente se encuentra entre un 15-50% de los pacientes después del primer año del trasplante, siendo aquellos que presentan unos valores séricos más elevados de PTH y calcio en el momento del trasplante los que tendrán mayor persistencia del HPTS a largo plazo230,231.
Hoy en día, desde la introducción del cinacalcet, el porcentaje de pacientes en diálisis que acceden al trasplante con PTH controlada se ha incrementado notablemente, presentándose un nuevo problema como es el de la decisión de suspender o no el cinacalcet en el momento del trasplante.
La persistencia del HPTS es un factor de riesgo de:
- Pérdida de masa ósea e incremento del riesgo de fractura231.
- Hipercalcemia. Su incidencia varía mucho dependiendo del valor y el momento postrasplante considerado. Entre otros efectos negativos cardiovasculares, también se ha valorado como uno de los múltiples factores responsables del fracaso del injerto renal a medio plazo232.
- Hipofosfatemia, probablemente también secundaria a los valores persistentemente elevados de FGF-23231,233.
- Deterioro de función renal y aparición de calcificaciones túbulo-intersticiales234.
Para el control de estas alteraciones, muchas veces lo más prudente puede ser esperar la evolución, manteniendo un estrecho control de los valores séricos de calcio, fósforo y PTH.
Las alternativas de tratamiento son dos:
- Paratiroidectomía. Ha mostrado ser efectiva para el control de la calcemia y mejoría de la DMO, aunque también se ha descrito un deterioro de función renal a corto plazo tras la paratiroidectomía235. Desde que se ha extendido el uso del cinacalcet, pensamos que la paratiroidectomía podría quedar reservada para los pacientes que no responden a este tratamiento, aunque en un estudio aleatorizado reciente la paratiroidectomía subtotal fue superior y más coste-efectiva que cinacalcet para el control del calcio plasmático si la duración del tratamiento con cinacalcet fuera superior a 14 meses236.
- Calcimiméticos (cinacalcet). Se ha mostrado efectivo en la normalización de la hipercalcemia e hipofosfatemia secundarias al hiperparatiroidismo persistente. No se ha descrito ningún efecto negativo sobre la función renal ni interacción con los inmunosupresores (anticalcineurínicos o inhibidores m-TOR)237–240. Además, podrían tener efecto beneficioso sobre la DMO240, aunque este hecho necesita más estudios para su confirmación.
Lo más aconsejable sería, en pacientes con calcemia superior a 10,5 mg/dL y PTHi > 100 pg/mL, iniciar el tratamiento con 30 mg/día y modificar dosis en función de la respuesta.
Pérdida de masa ósea y fracturas
Diferentes estudios prospectivos han mostrado que en los seis primeros meses del trasplante renal ocurre una pérdida rápida de la DMO, del orden del 7 al 10%, que afecta principalmente al hueso esponjoso (trabecular)231. A nivel de columna lumbar esta pérdida es de 1,5% por mes. A nivel de fémur proximal también se ha descrito una pérdida ósea significativa. Esta disminución de DMO se estabiliza o tiende a recuperarse después de los 12 meses231,241,242.
Estos hallazgos destacan la importancia del inicio de las medidas profilácticas desde el momento del trasplante.
En cuanto a la pérdida ósea a largo plazo, se observan discrepancias entre los estudios, constatándose en unos una tasa de pérdida ósea del 1-2% por año a nivel de la columna lumbar, mientras que en otros no se demuestran cambios e incluso se objetiva un ligero incremento en la DMO. Estas discrepancias pueden ser debidas al uso de diferentes dosis de mantenimiento de corticoides.
La pérdida ósea rápida que ocurre después del trasplante condiciona una elevada prevalencia (7-20%) e incidencia (3-4% por año) de fracturas. La tasa de fractura de cadera es de 3,3/1.000 personas-año, lo que supone un 34% más elevada en comparación con pacientes en la lista de espera de trasplante renal243, y según el United States Renal Data System (USRDS), un 22,5% de pacientes trasplantados sufrieron una fractura durante los primeros cinco años244.
Las fracturas, consecuencia de la pérdida ósea inicial, suelen ocurrir en el postrasplante tardío, y aunque la pérdida ósea es preferentemente a nivel del hueso trabecular, la mayoría afectan al esqueleto apendicular, particularmente a pies y tobillos231,244.
Al ser la fractura vertebral un potente factor de riesgo para el desarrollo futuro de fracturas, su detección da la oportunidad de intervenir en la prevención secundaria. De ahí que deba incorporarse una técnica de imagen para la detección de deformidades vertebrales asintomáticas en los pacientes trasplantados con mayor riesgo de fractura.
Actualmente, en los pacientes trasplantados (estadio 1T-5T) con factores de riesgo para osteoporosis en las guías KDIGO 2017 se sugiere medir la DMO para valorar el riesgo de fractura si los resultados afectarán la actitud terapéutica4.
De manera ambigua, las KDIGO sugieren globalmente en los pacientes trasplantados y, al menos, un FG > 30 mL/min/1,73 m2 y DMO disminuida, tratamiento con vitamina D, calcidiol/alfacalcidol y/o agentes antirresortivos durante los primeros 12 meses tras el trasplante, dependiendo de los valores séricos de calcio, fósforo, PTH, fosfatasa alcalina y calcidiol4.
Recomendaciones para la prevención de la pérdida de masa ósea y fracturas postrasplante renal (figs. 13-15)
La prevención de la pérdida ósea y de las fracturas comienza en el momento del trasplante, pero más allá de la disminución de la dosis de corticosteroides, el grado de evidencia de las distintas terapias es bajo245.
- Inmunosupresores
- La primera medida es minimizar las dosis de corticosteroides y suspenderlos desde el momento en que se considere seguro.
- Suplementos de vitamina D y calcio
Se sugiere la normalización de la ingesta de calcio, si es posible con calcio procedente de la dieta o con la administración de suplementos de calcio oral (por ejemplo, 0,5 g/día) y la suplementación con vitamina D de 800-1000 UI/día, bien en forma de colecalciferol o calcidiol. También el uso de metabolitos activos de vitamina D (calcitriol, α-calcidol o paricalcitol) previenen la pérdida de masa ósea en los primeros meses del trasplante246–250.
Se recomienda medir periódicamente tras el trasplante (cada seis meses o un año) los niveles de 25(OH)D3, y normalizarlos administrando colecalciferol o 25(OH)D3 (calcidiol) en forma de dosis diaria (800-1000 UI/día) o en pauta mensual o quincenal.
- Bisfosfonatos
Los bisfosfonatos, en combinación con suplementos de calcio y vitamina D, también se han mostrado eficaces en la prevención de la pérdida ósea postrasplante, así como en el tratamiento de la osteoporosis251–258. Todos los bisfosfonatos, tanto el pamidronato i.v. como el ibandronato oral mensual o i.v., el risedronato oral semanal o el alendronato semanal, se han mostrado igual de eficaces251–257. Un metaanálisis reciente mostró un aumento del 6% de la DMO femoral y un 7,4% la DMO lumbar sin afectar la creatinina sérica o el calcio plasmático, pero no se observaron diferencias en la incidencia de fracturas respecto a controles, probablemente por tratarse de una muestra pequeña y corto período de seguimiento259.
Recomendamos la práctica de una densitometría ósea y de una radiografía lateral de columna torácica y lumbar durante la hospitalización del postrasplante, al menos en los receptores con más riesgo de fractura, valorado por criterios clínicos (es decir, sexo, edad, diabetes, tipo de donante) o quizá por FRAX260,261. En lugar de la radiografía, puede ser útil la medición del TBS o la morfometría vertebral obtenida con los nuevos equipos DEXA262. En función de la DMO y valores de PTH evaluaremos el inicio de bisfosfonatos.
En los pacientes de riesgo se aconseja también repetir la exploración al año. Si aparece un empeoramiento significativo en la densitometría al año, o nuevas fracturas, el tratamiento estándar debe ser un bisfosfonato (alendronato, risedronato o ibandronato por vía oral) u otro agente antiresortivo durante un período de tiempo más prolongado.
Posteriormente, podríamos espaciar la DXA cada dos o tres años.
- Denosumab
La administración de denosumab en el primer año postrasplante incrementa la DMO con un efecto terapéutico superior al de las otras alternativas de tratamiento antes descritas263,264.
Deben vigilarse la calcemia y la PTH en unos 15 días después de la primera dosis, por el riesgo de hipocalcemia y el incremento agudo de la PTH. Para evitarla, se recomienda la administración simultánea diaria de vitamina D y calcio oral.
Se ha descrito un aumento de las infecciones urinarias no graves, aunque es algo que es necesario vigilar264,265.
Se administra subcutáneamente a dosis de 60 μg cada seis meses. No necesita ajuste de dosis con la función renal, por lo que estaría principalmente indicado en pacientes trasplantados con deterioro significativo de la función renal o intolerancia a bisfosfonatos.
- Hormona paratiroidea
La teriparatida no se ha mostrado eficaz para prevenir la pérdida de masa ósea postrasplante.
Su empleo debería reservarse para receptores de trasplante con alto riesgo de fractura (fracturas previas, osteoporosis grave –especialmente con fracturas vertebrales incluso agudas-) y sospecha de EOA, como pueden ser aquellos de edad avanzada (> 65 años), diabéticos y con valores séricos muy bajos de PTH (< 60 pg/mL). Se administra en dosis diaria subcutánea de 20 μg aunque puede popularizarse con otras dosis semanales266.
En pacientes receptores de trasplante renal con hipoparatiroidismo (paratiroidectomía previa), en los que la hipocalcemia todavía puede agravarse más con el empleo de esteroides, la teriparatida podría ser una interesante opción terapéutica que ayudara al adecuado control del calcio sérico231 en espera de la aprobación de otras moléculas con indicación específica para el hipoparatiroidismo.
Financiación
Este trabajo no ha recibido ningún tipo de financiación.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- National Kidney Foundation.National Kidney Foundation: K/DOQI Clinical Practice Guidelines for bone metabolism and disease in chronic kidney disease.
Am J Kidney Dis., 42 (2003), pp. 1-201 Medline
- S. Moe, T. Drueke, J. Cunningham, W. Goodman, K. Martin, K. Olgaard, et al.
Definition, evaluation, and classification of renal osteodystrophy: a position statement from Kidney Disease: Improving Global Outcomes (KDIGO).Kidney Int., 69 (2006), pp. 1945-1953
- Kidney Disease: Improving Global Outcomes (KDIGO) CKD–MBD Work Group.KDIGO clinical practice guideline for the diagnosis, evaluation, prevention, and treatment of chronic kidney disease–mineral and bone disorder (CKD–MBD).Kidney Int., 76 (2009), pp. S1-S130
- Kidney Disease: Improving Global Outcomes (KDIGO) CKD-MBD Update Work Group.KDIGO 2017 Clinical Practice Guideline Update for the Diagnosis, Evaluation, Prevention, and Treatment of Chronic Kidney Disease–Mineral and Bone Disorder (CKD-MBD).Kidney Int Suppl., 7 (2017), pp. 1-59
- F. Llach, J. Bover.Renal Osteodystrophies.The Kidney, 6th Edition, pp. 2103-2186
- I. Martinez, R. Saracho, J. Montenegro, F. Llach.
A déficit of calcitriol synthesis may not be the initial factor in the pathogenesis of secondary hyperparathyroidism.Nephrol Dial Transplant., 11 (1996), pp. 22-28
- V. Lorenzo.Utilidad de los parámetros urinarios en la enfermedad renal crónica avanzada.Nefrologia., 39 (2019), pp. 124-132
- J. Michaud, J. Naud, D. Ouimet, C. Demers, J.L. Petit, F.A. Leblond, et al.
Reduced hepatic synthesis of calcidiol in uremia.J Am Soc Nephrol., 21 (2010), pp. 1488-1497 http://dx.doi.org/10.1681/ASN.2009080815 | Medline
- O.M. Kuro.The Klotho proteins in health and disease.Nat Rev Nephrol., 15 (2019), pp. 27-44
- O.M. Kuro.Phosphate and Klotho.Kidney Int Suppl., 79 (2011), pp. S20-S23
- J.R. Muñoz-Castañeda, C. Herencia, M.V. Pendón-Ruiz de Mier, M.E. Rodriguez-Ortiz, J.M. Diaz-Tocados, N. Vergara, et al.
Differential regulation of renal Klotho and FGFR1 in normal and uremic rats.FASEB J., 31 (2017), pp. 3858-3867
- P.P. Centeno, A. Herberger, H.G. Mun, C.H. Tu, E.F. Nemeth, W. Chang, et al.
Phosphate acts directly on the calcium-sensing receptor to stimulate parathyroid hormone secretion.Nat Commun., 10 (2019), pp. 4693
- C.H. Hsu, S.R. Patel.Uremic toxins and vitamin D metabolism.Kidney Int., 62 (1997), pp. s65-s68
- Y. Almaden, A. Canalejo, A. Hernandez, E. Ballesteros, S. Garcia-Navarro, A. Torres, et al.Direct effect of phosphorus on PTH secretion from whole rat parathyroid glands in vitro.J Bone Miner Res., 11 (1996), pp. 970-976
- E. Slatopolsky, J. Finch, M. Denda, C. Ritter, M. Zhong, P.N. MacDonald, et al.
Phosphorus restriction prevents parathyroid gland growth. High phosphorus directly stimulates PTH secretion in vitro.J Clin Invest., 97 (1996), pp. 2534-2540
- P.K. Nielsen, U. Feldt-Rasmussen, K. Olgaard.
A direct effect in vitro of phosphate on PTH release from bovine parathyroid tissue slices but not from dispersed parathyroid cells.Nephrol Dial Transplant., 11 (1996), pp. 1762-1768
- Y. Almaden, A. Hernandez, V. Torregrosa, A. Canalejo, L. Sabate, L. Fernandez Cruz, et al.High phosphate level directly stimulates parathyroid hormone secretion and synthesis by human parathyroid tissue in vitro.J Am Soc Nephrol., 9 (1998), pp. 1845-1852
- Y. Geng, L. Mosyak, I. Kurinov, H. Zuo, E. Sturchler, T.C. Cheng, et al.Structural mechanism of ligand activation in human calcium-sensing receptor.Elife., 5 (2016), pp. e13662
- N. Carrillo-Lopez, D. Alvarez-Hernandez, I. Gonzalez-Suarez, P. Román-García, J.M. Valdivielso, J.L. Fernández-Martín, et al.
Simultaneous changes in the calcium-sensing receptor and the vitamin D receptor under the influence of calcium and calcitriol.Nephrol Dial Transplant., 23 (2008), pp. 3479-3484 http://dx.doi.org/10.1093/ndt/gfn338 | Medline
- M.E. Rodriguez, Y. Almaden, S. Cañadillas, A. Canalejo, E. Siendones, I. Lopez, et al.
The calcimimetic R-568 increases vitamin D receptor expression in rat parathyroid glands.Am J Physiol Renal Physiol., 292 (2007), pp. F1390-F1395 http://dx.doi.org/10.1152/ajprenal.00262.2006 | Medline
- M. Miura, Y. Iwazu, K. Shiizaki, T. Akimoto, K. Kotani, M. Kurabayashi, et al.Identification and quantification of plasma calciprotein particles with distinct physical properties in patients with chronic kidney disease.Sci Rep., 8 (2018), pp. 1256http://dx.doi.org/10.1038/s41598-018-19677-4 | Medline
- F.J. Mendoza, I. Lopez, A. Montes de Oca, J. Perez, M. Rodriguez, E. Aguilera-Tejero.Metabolic acidosis inhibits soft tissue calcification in uremic rats.Kidney Int., 73 (2008), pp. 407-414
- W.Y. Qunibi.Consequences of hyperphosphatemia in patients with end-stage renal disease (ESRD).Kidney Int., 90 (2004), pp. S8-S12
- J.J. Scialla, M. Wolf.Roles of phosphate and fibroblast growth factor 23 in cardiovascular disease.Nat Rev Nephrol., 10 (2014), pp. 268-278
- J. Bover, J. Egido, E. Fernández-Giráldez, M. Praga, C. Solozábal-Campos, J.V. Torregrosa, et al.Vitamin D, vitamin D receptor and the importance of its activation in patients with chronic kidney disease.Nefrologia., 35 (2015), pp. 28-41http://dx.doi.org/10.3265/Nefrologia.pre2014.Sep.11796 | Medline
- C. Faul, A.P. Amaral, B. Oskouei, M.C. Hu, A. Sloan, T. Isakova, et al.FGF23 induces left ventricular hypertrophy.J Clin Invest., 121 (2011), pp. 4393-4408http://dx.doi.org/10.1172/JCI46122 | Medline
- R.G. Erben.Update on FGF23 and Klotho signaling.Mol Cell Endocrinol., 432 (2016), pp. 56-65http://dx.doi.org/10.1016/j.mce.2016.05.008 | Medline
- O.M. Kuro.The FGF23 and Klotho system beyond mineral metabolism.Clin Exp Nephrol., 21 (2017), pp. 64-69http://dx.doi.org/10.1007/s10157-016-1357-6 | Medline
- S.K. Ganesh, A.G. Stack, N.W. Levin, T. Hulbert-Shearon, F.K. Port.Association of elevated serum PO4 Ca x PO4 product, and parathyroid hormone with cardiac mortality risk in chronic hemodialysis patients.J Am Soc Nephrol., 12 (2001), pp. 2131-2138http://dx.doi.org/10.1681/ASN.V12102131 | Medline
- L.A. Stevens, O. Djurdjev, S. Cardew, E.C. Cameron, L. Adeera.Calcium, phosphate, and parathyroid hormone levels in combination and as a function of dialysis duration predict mortality: evidence for the complexity of the association between mineral metabolism and outcomes.J Am Soc Nephrol., 15 (2004), pp. 770-799http://dx.doi.org/10.1097/01.asn.0000113243.24155.2f | Medline
- G.A. Block, J. Cunningham.Morbidity and mortality associated with abnormalities in bone and mineral metabolism in CKD.Clinical Guide to the Basics of Bone and Mineral Metabolism in CKD, pp. 77-92
- M.G. Vervloet, Z.A. Massy, V.M. Brandenburg, S. Mazzaferro, M. Cozzolino, P. Ureña-Torres, et al.Bone: a new endocrine organ at the heart of chronic kidney disease and mineral and bone disorders.Lancet Diabetes Endocrinol., 2 (2014), pp. 427-436http://dx.doi.org/10.1016/S2213-8587(14)70059-2 | Medline
- A. Rodriguez-Benot, A. Martin-Malo, M.A. Alvarez-Lara, M. Rodríguez, P. Aljama.Mild hyperphosphatemia and mortality in hemodialysis patients.Am J Kidney Dis., 46 (2005), pp. 68-77http://dx.doi.org/10.1053/j.ajkd.2005.04.006 | Medline
- A. Covic, M. Vervloet, Z.A. Massy, P.U. Torres, D. Goldsmith, V. Brandenburg, et al.Bone and mineral disorders in chronic kidney disease: implications for cardiovascular health and ageing in the general population.Lancet Diabetes Endocrinol., 6 (2018), pp. 319-331http://dx.doi.org/10.1016/S2213-8587(17)30310-8 | Medline
- G.A. Block, P.S. Klassen, J.M. Lazarus, N. Ofsthun, E.G. Lowrie, G.M. Chertow.Mineral metabolism, mortality, and morbidity in maintenance hemodialysis. J Am Soc Nephrol., 15 (2004), pp. 2208-2218
- Y. Slinin, R.N. Foley, A.J. Collins.Calcium, phosphorus, parathyroid hormone, and cardiovascular disease in hemodialysis patients: The USRDS Waves 1, 3, and 4 study. J Am Soc Nephrol., 16 (2005), pp. 1788-1793http://dx.doi.org/10.1681/ASN.2004040275 | Medline
- W.N. Suki, R. Zabaneh, J.L. Cangiano, J. Reed, D. Fisher, L. Garret, et al.Effects of sevelámer and calcium-based phosphate binders on mortality in hemodialysis patients.Kidney Int., 72 (2007), pp. 1130-1137http://dx.doi.org/10.1038/sj.ki.5002466 | Medline
- G.M. Chertow, G.A. Block, R. Correa-Rotter, T.B. Drüeke, J. Floege, W.G. Goodman, et al.Effect of cinacalcet on cardiovascular disease in patients undergoing dialysis.N Engl J Med., 367 (2012), pp. 2482-2494http://dx.doi.org/10.1056/NEJMoa1205624 | Medline
- K.J. Martin, K. Olgaard, J.W. Coburn, G.M. Coen, M. Fukawa, C. Langman, et al.Diagnosis, assessment, and treatment of bone turnover abnormalities in renal osteodystrophy.Am J Kidney Dis., 43 (2004), pp. 558-565 http://dx.doi.org/10.1053/j.ajkd.2003.12.003 | Medline
- [K. Jindal, C.T. Chan, C. Deziel, D. Hirsch, S.D. Soroka, M. Tonelli, et al.Hemodialysis Clinical Practice Guidelines for the Canadian Society of Nephrology: Mineral Metabolism.J Am Soc Nephrol., 17 (2006), pp. S11-S16
- E. Gonzalez-Parra, M.D. Arenas, J. Valencia, M. Angoso.
- J.C. Souberbielle, A. Boutten, M.C. Carlier, D. Chevenne, G. Coumaros, E. Lawson-Body, et al.Inter-method variability in PTH measurement: implication for the care of CKD patients.Kidney Int., 70 (2006), pp. 345-350
- [A.S. Levey, J. Coresh, T. Greene, J. Marsh, L.A. Stevens, J.W. Kusek, et al.Expressing the Modification of Diet in Renal Disease Study equation for estimating glomerular filtration rate with standardized serum creatinine values.Clin Chem., 53 (2007), pp. 766-772
- C.L.M. de Roij van Zuijdewijn, D.E. de Haseth, B. van Dam, W.A. Bax, M.P.C. Grooteman, M.L. Bots, et al.Role of Albumin Assay on Calcium Levels and Prescription of Phosphate Binders in Chronic Hemodialysis Patients. Nephron., 140 (2018), pp. 211-217http://dx.doi.org/10.1159/000492238 | Medline
- C. Gauci, O. Morante, B. Fouqueray, R. de la Faille, G. Maruani, J.P. Haymann, et al.Pitfalls of measuring total blood calcium in patients with CKD. J Am Soc Nephrol., 19 (2008), pp. 1592-1598 http://dx.doi.org/10.1681/ASN.2007040449 | Medline
- M. Monfort, P. Delanaye, J.P. Chapelle, E. Cavalier.Plasma calcium in haemodialysis patients: total calcium or ionized calcium? Should we systematically provide a value of total corrected calcium on our protocols?. Ann Biol Clin (Paris)., 66 (2008), pp. 573-576
- P. Ferrari, R. Singer, A. Agarwal, A. Hurn, M.A. Townsend, P. Chubb.Serum phosphate is an important determinant of corrected serum calcium in end-stage kidney disease.Nephrology (Carlton)., 14 (2009), pp. 383-388http://dx.doi.org/10.1111/j.1440-1797.2009.01121.x | Medline
- S.M. Sprague, E. Bellorin-Font, V. Jorgetti, A.B. Carvalho, H.H. Malluche, A. Ferreira, et al.Diagnostic Accuracy of Bone Turnover Markers and Bone Histology in Patients With CKD Treated by Dialysis. Am J Kidney Dis., 67 (2016), pp. 559-566http://dx.doi.org/10.1053/j.ajkd.2015.06.023 | Medline
- T. Isakova, T.L. Nickolas, M. Denburg, S. Yarlagadda, D.E. Weiner, O.M. Gutiérrez, et al.KDOQI US Commentary on the 2017 KDIGO Clinical Practice Guideline Update for the Diagnosis, Evaluation Prevention, and Treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD). Am J Kidney Dis., 70 (2017), pp. 737-751 http://dx.doi.org/10.1053/j.ajkd.2017.07.019 | Medline
- J.V. Torregrosa, J. Bover, J. Cannata Andía, V. Lorenzo, A.L. de Francisco, I. Martínez, et al.Spanish Nephrology Society Spanish Society of Nephrology recommendations for controlling mineral and bone disorder in chronic kidney disease patients (S.E.N.-M.B.D.). Nefrologia., 31 (2011), pp. 3-32http://dx.doi.org/10.3265/Nefrologia.pre2011.Jan.10816 | Medline
- G.M. London, F. Fabiani, S.J. Marchais, M.C. de Vernejoul, A.P. Guerin, M.E. Safar, et al.Uremic cardiomyopathy: an inadequate left ventricular hypertrophy.Kidney Int., 31 (1987), pp. 973-980 http://dx.doi.org/10.1038/ki.1987.94 | Medline
- J.L. Fernández-Martín, P. Martínez-Camblor, M.P. Dionisi, J. Floege, M. Ketteler, G. London, et al.COSMOS group Improvement of mineral and bone metabolism markers is associated with better survival in haemodialysis patients: the COSMOS study. Nephrol Dial Transplant., 30 (2015), pp. 1542-1551
- C. de la Piedra, E. Fernández, M.L. González Casaus, E. González Parra.Different biological functions in PTH molecules. What are we measuring?. Nefrologia., 28 (2008), pp. 123-128 Medline
- M.L. González-Casaus, E. González-Parra, C. Sánchez-González, M. Albalate, C. de la Piedra-Gordo, E. Fernández, et al.A lower proportion of circulating active parathyroid hormone in peritoneal dialysis does not allow the pth inter-method adjustment proposed for haemodialysis. Nefrologia., 34 (2014), pp. 330-340http://dx.doi.org/10.3265/Nefrologia.pre2014.Feb.12384 | Medline
- B. Hocher, S. Zeng.Clear the Fog around Parathyroid Hormone Assays. What Do iPTH Assays Really Measure?. Clin J Am Soc Nephrol., 13 (2018), pp. 524-526 http://dx.doi.org/10.2215/CJN.01730218 | Medline
- S.A. Strugnell, S.M. Sprague, A. Ashfaq, M. Petkovich, C.W. Bishop.Rationale for Raising Current Clinical Practice Guideline Target for Serum 25-Hydroxyvitamin D in Chronic Kidney Disease. Am J Nephrol., 49 (2019), pp. 284-293http://dx.doi.org/10.1159/000499187 | Medline
- A.H. Berg, R.I. Thadhani.Aiming Too Low: Reevaluation of Target Concentrations of Serum 25-Hydroxyvitamin D in Secondary Hyperparathyroidism. Am J Nephrol., 49 (2019), pp. 281-283http://dx.doi.org/10.1159/000499160 | Medline
- Y. Zhang, D. Darssan, E.M. Pascoe, D.W. Johnson, H. Pi, J. Dong, et al.Vitamin D status and mortality risk among patients on dialysis: a systematic review and meta-analysis of observational studies. Nephrol Dial Transplant., 33 (2018), pp. 1742-1751http://dx.doi.org/10.1093/ndt/gfy016 | Medline
- J.E. Manson, N.R. Cook, I.M. Lee, W. Christen, S.S. Bassuk, S. Mora, et al.Vitamin D Supplements and Prevention of Cancer and Cardiovascular Disease. N Engl J Med., 380 (2019), pp. 33-44 http://dx.doi.org/10.1056/NEJMoa1809944 | Medline
- J. Bover, P. Ureña-Torres, M. Cozzolino, M. Rodríguez-García, C. Gómez-Alonso.The Non-invasive Diagnosis of Bone Disorders in CKD.Calcif Tissue Int., 108 (2021), pp. 512-527
- A. Pimentel, P. Ureña-Torres, M.C. Zillikens, J. Bover, M. Cohen-Solal.Fractures in patients with CKD-diagnosis, treatment, and prevention: a review by members of the European Calcified Tissue Society and the European Renal Association of Nephrology Dialysis and Transplantation. Kidney Int., 92 (2017), pp. 1343-1355http://dx.doi.org/10.1016/j.kint.2017.07.021 | Medline
- J. Bover, P. Ureña, A. Aguilar, S. Mazzaferro, S. Benito, V. López-Báez, et al.Alkaline Phosphatases in the Complex Chronic Kidney Disease-Mineral and Bone Disorders. Calcif Tissue Int., 103 (2018), pp. 111-124http://dx.doi.org/10.1007/s00223-018-0399-z | Medline
- P. Evenepoel, J. Cunningham, S. Ferrari, M. Haarhaus, M.K. Javaid, M.H. Lafage-Proust, et al.European Consensus Statement on the diagnosis and management of osteoporosis in chronic kidney disease stages G4-G5D. Nephrol Dial Transplant., 36 (2021), pp. 42-59 http://dx.doi.org/10.1093/ndt/gfaa192 | Medline
- D.L. Regidor, C.P. Kovesdy, R. Mehrotra, M. Rambod, J. Jing, C.J. McAllister, et al.Serum alkaline phosphatase predicts mortality among maintenance hemodialysis patients. J Am Soc Nephrol., 19 (2008), pp. 2193-2203http://dx.doi.org/10.1681/ASN.2008010014 | Medline
- R. Shantouf, C.P. Kovesdy, Y. Kim, N. Ahmadi, A. Luna, C. Luna, et al.Association of serum alkaline phosphatase with coronary artery calcification in maintenance hemodialysis patients. Clin J Am Soc Nephrol., 4 (2009), pp. 1106-1114 http://dx.doi.org/10.2215/CJN.06091108 | Medline
- M. Haarhaus, V. Brandenburg, K. Kalantar-Zadeh, P. Stenvinkel, P. Magnusson.Alkaline phosphatase: a novel treatment target for cardiovascular disease in CKD. Nat Rev Nephrol., 13 (2017), pp. 429-442 http://dx.doi.org/10.1038/nrneph.2017.60 | Medline
- R. Villa-Bellosta, E. González-Parra, J. Egido.Alkalosis and Dialytic Clearance of Phosphate Increases Phosphatase Activity: A Hidden Consequence of Hemodialysis. PLoS One., 11 (2016), pp. e0159858http://dx.doi.org/10.1371/journal.pone.0159858 | Medline
- D. Azpiazu, E. González-Parra, J. Egido, R. Villa-Bellosta.Hydrolysis of Extracellular Pyrophosphate increases in post-hemodialysis plasma. Sci Rep., 8 (2018), pp. 11089 http://dx.doi.org/10.1038/s41598-018-29432-4 | Medline
- D. Azpiazu, E. González-Parra, A. Ortiz, J. Egido, R. Villa-Bellosta.Impact of post-dialysis calcium level on ex vivo rat aortic wall calcification. PLoS One., 12 (2017), pp. e0183730http://dx.doi.org/10.1371/journal.pone.0183730 | Medline
- D. Azpiazu, S. Gonzalo, E. González-Parra, J. Egido, R. Villa-Bellosta.Role of pyrophosphate in vascular calcification in chronic kidney disease. Nefrologia., 38 (2018), pp. 250-257 http://dx.doi.org/10.1016/j.nefro.2017.07.005 | Medline
- P. Raggi, A. Bellasi, D. Bushinsky, J. Bover, M. Rodriguez, M. Ketteler, et al.Slowing Progression of Cardiovascular Calcification With SNF472 in Patients on Hemodialysis: Results of a Randomized Phase 2b Study. Circulation., 141 (2020), pp. 728-739
- F. Caravaca, G. García-Pino, R. Martínez-Gallardo, F. Ferreira-Morong, E. Luna, R. Alvarado, et al.Increased serum phosphate concentrations in patients with advanced chronic kidney disease treated with diuretics. Nefrologia., 33 (2013), pp. 486-494 http://dx.doi.org/10.3265/Nefrologia.pre2013.Feb.11872 | Medline
- F. Caravaca, F. Caravaca-Fontán, L. Azevedo, E. Luna.Cómo estimar la eficacia de un captor del fósforo. Nefrologia., 37 (2017), pp. 311-319
- M.V. Pendón-Ruiz de Mier, N. Vergara, C. Rodelo-Haad, M.D. López-Zamorano, C. Membrives-González, R. López-Baltanás, et al.Assessment of Inorganic Phosphate Intake by the Measurement of the Phosphate/Urea Nitrogen Ratio in Urine. Nutrients., 13 (2021), pp. 292http://dx.doi.org/10.3390/nu13020292 | Medline
- S. de Seigneux, M. Courbebaisse, J.M. Rutkowski, A. Wilhelm-Bals, M. Metzger, S.N. Khodo, et al.Proteinuria Increases Plasma Phosphate by Altering Its Tubular Handling. J Am Soc Nephrol., 26 (2015), pp. 1608-1618http://dx.doi.org/10.1681/ASN.2014010104 | Medline
- T. Isakova, X. Cai, J. Lee, D. Xie, X. Wang, R. Mehta, et al.Longitudinal FGF23 Trajectories and Mortality in Patients with CKD.J Am Soc Nephrol., 29 (2018), pp. 579-590
- O.M. Gutiérrez, M. Mannstadt, T. Isakova, J.A. Rauh-Hain, H. Tamez, A. Shah, et al.Fibroblast growth factor 23 and mortality among patients undergoing hemodialysis. N Engl J Med., 359 (2008), pp. 584-592http://dx.doi.org/10.1056/NEJMoa0706130 | Medline
- B. Richter, C. Faul.FGF23 Actions on Target Tissues-With and Without Klotho. Front Endocrinol (Lausanne)., 9 (2018), pp. 189 http://dx.doi.org/10.3389/fendo.2018.00189 | Medline
- M.G. Vervloet.FGF23 measurement in chronic kidney disease: What is it really reflecting?. Clin Chim Acta., 505 (2020), pp. 160-166http://dx.doi.org/10.1016/j.cca.2020.03.013 | Medline
- E.R. Smith.Calciprotein particles: A mineral biomarker in need of better measurement.Atherosclerosis., 303 (2020), pp. 43-45http://dx.doi.org/10.1016/j.atherosclerosis.2020.04.017 | Medline
- T.L. Nickolas.The Quest for Better Biomarkers of Bone Turnover in CKD.J Am Soc Nephrol., 29 (2018), pp. 1353-1355
- T. Adragao, A. Pires, C. Lucas, R. Birne, L. Magalhaes, M. Gonçalves, et al.A simple vascular calcification score predicts cardiovascular risk in haemodialysis patients.Nephrol Dial Transplant., 19 (2004), pp. 1480-1488http://dx.doi.org/10.1093/ndt/gfh217 | Medline
- L.I. Kauppila, J.F. Polak, L.A. Cupples, M.T. Hannan, D.P. Kiel, P.W. Wilson.New indices to classify location, severity and progression of calcific lesions in the abdominal aorta: a 25-year follow-up study.Atherosclerosis., 132 (1997), pp. 245-250http://dx.doi.org/10.1016/s0021-9150(97)00106-8 | Medline
- J.L. Górriz, P. Molina, M.J. Cerverón, R. Vila, J. Bover, J. Nieto, et al.Vascular Calcification in Patients with Nondialysis CKD over 3 Years. Clin J Am Soc Nephrol., 10 (2015), pp. 654-666http://dx.doi.org/10.2215/CJN.07450714 | Medline
- A. Bellasi, P. Raggi.Techniques and technologies to assess vascular calcification.Semin Dial., 20 (2007), pp. 129-133http://dx.doi.org/10.1111/j.1525-139X.2007.00259.x | Medline
- M. Nakayama, Y. Kaizu, M. Nagata, Y. Ura, H. Ikeda, S. Shimamoto, et al.Fibroblast growth factor 23 is associated with carotid artery calcification in chronic kidney disease patients not undergoing dialysis: a cross-sectional study. BMC Nephrol., 14 (2013), pp. 22 http://dx.doi.org/10.1186/1471-2369-14-22 | Medline
- J. Bover, P. Ureña-Torres, M.J. Lloret, C. Ruiz-García, I. DaSilva, M.M. Diaz-Encarnacion, et al.Integral pharmacological management of bone mineral disorders in chronic kidney disease (part I): from treatment of phosphate imbalance to control of PTH and prevention of progression of cardiovascular calcification. Expert Opin Pharmacother., 17 (2016), pp. 1247-1258 http://dx.doi.org/10.1080/14656566.2016.1182155 | Medline
- J. Bover, P. Ureña-Torres, M.J. Lloret, C. Ruiz-García, I. DaSilva, M.M. Diaz-Encarnacion, et al.Integral pharmacological management of bone mineral disorders in chronic kidney disease (part II): from treatment of phosphate imbalance to control of PTH and prevention of progression of cardiovascular calcification. Expert Opin Pharmacother., 17 (2016), pp. 1363-1373 http://dx.doi.org/10.1080/14656566.2016.1182985 | Medline
- C. Zoccali, G. London.Opponent’s comments. Nephrol Dial Transplant., 30 (2015), pp. 351-352 http://dx.doi.org/10.1093/ndt/gfv020a | Medline
- J. Bover, P. Ureña-Torres, J.V. Torregrosa, M. Rodríguez-García, C. Castro-Alonso, J.L. Górriz, et al.Osteoporosis, bone mineral density and CKD-MBD complex (I): Diagnostic considerations. Nefrologia., 38 (2018), pp. 476-490 http://dx.doi.org/10.1016/j.nefro.2017.12.006 | Medline
- S.M. Moe, T.L. Nickolas.Fractures in Patients with CKD: Time for Action. Clin J Am Soc Nephrol., 11 (2016), pp. 1929-1931 http://dx.doi.org/10.2215/CJN.09500916 | Medline
- P. Khairallah, T.L. Nickolas.Management of Osteoporosis in CKD. Clin J Am Soc Nephrol., 13 (2018), pp. 962-969 http://dx.doi.org/10.2215/CJN.11031017 | Medline
- K.L. Naylor, A.X. Garg, G. Zou, L. Langsetmo, W.D. Leslie, L.A. Fraser, et al.Comparison of fracture risk prediction among individuals with reduced and normal kidney function. Clin J Am Soc Nephrol., 10 (2015), pp. 646-653 http://dx.doi.org/10.2215/CJN.06040614 | Medline
- S.A. Jamal, S.L. West, T.L. Nickolas.The clinical utility of FRAX to discriminate fracture status in men and women with chronic kidney disease. Osteoporos Int., 25 (2014), pp. 71-76 http://dx.doi.org/10.1007/s00198-013-2524-1 | Medline
- T. Yamaguchi, E. Kanno, J. Tsubota, T. Shiomi, M. Nakai, S. Hattori.Retrospective study on the usefulness of radius and lumbar bone density in the separation of hemodialysis patients with fractures from those without fractures. Bone., 19 (1996), pp. 549-555 http://dx.doi.org/10.1016/s8756-3282(96)00246-3 | Medline
- P. Ureña, O. Bernard-Poenaru, A. Ostertag, C. Baudoin, M. Cohen-Solal, T. Cantor, et al.Bone mineral density, biochemical markers and skeletal fractures in hemodialysis patients. Nephrol Dial Transplant., 18 (2003), pp. 2325-2331
- A. Muxi, J.V. Torregrosa, D. Fuster, P. Peris, S. Vidal-Sicart, O. Solá, et al.Arteriovenous fistula affects bone mineral density measurements in end-stage renal failure patients. Clin J Am Soc Nephrol., 4 (2009), pp. 1494-1499 http://dx.doi.org/10.2215/CJN.01470209 | Medline
- P. Evenepoel, P. D’Haese, J. Bacchetta, J. Cannata-Andia, A. Ferreira, M. Haarhaus, et al.Bone biopsy practice patterns across Europe: the European renal osteodystrophy initiative-a position paper. Nephrol Dial Transplant., 32 (2017), pp. 1608-1613 http://dx.doi.org/10.1093/ndt/gfw468 | Medline
- P.D. Miller.The Role of Bone Biopsy in Patients with Chronic Renal Failure. Clin J Am Soc Nephrol., 3 (2008), pp. S140-S150 http://dx.doi.org/10.2215/CJN.02430508 | Medline
- S. Disthabanchong, S. Boongird.Role of different imaging modalities of vascular calcification in predicting outcomes in chronic kidney disease. World J Nephrol., 6 (2017), pp. 100-110
- P.1. Raggi, G.M. Chertow, P.U. Torres, B. Csiky, A. Naso, K. Nossuli, et al.The ADVANCE study: a randomized study to evaluate the effects of cinacalcet plus low-dose vitamin D on vascular calcification in patients on hemodialysis. Nephrol Dial Transplant., 26 (2011), pp. 1327-1339 http://dx.doi.org/10.1093/ndt/gfq725 | Medline
- Callister F T.Q., B. Cooil, S.P. Raya, N.J. Lippolis, D.J. Russo, P. Raggi.Coronary artery disease: improved reproducibility of calcium scoring with an electron-beam volumetric method. Radiology., 208 (1998), pp. 807-814 http://dx.doi.org/10.1148/radiology.208.3.9722864 | Medline
- P. Evenepoel, J. Bover, P. Ureña Torres.Parathyroid hormone metabolism and signaling in health and chronic kidney disease. Kidney Int., 90 (2016), pp. 1184-1190 http://dx.doi.org/10.1016/j.kint.2016.06.041 | Medline
- J. Bover, C. Arana, P. Ureña, A. Torres, A. Martín-Malo, L. Fayos, et al.Hiporrespuesta o resistencia a la acción de la hormona paratiroidea en la enfermedad renal crónica. Nefrología., 41 (2021), pp. 514-528 http://dx.doi.org/10.1016/j.nefroe.2021.11.014 | Medline
- J.A. Ramirez, M. Emmett, M.G. White, N. Fathi, C.A. Santa Ana, S.G. Morawski, et al.The absorption of dietary phosphorus and calcium in hemodialysis patients. Kidney Int., 30 (1986), pp. 753-759 http://dx.doi.org/10.1038/ki.1986.252 | Medline
- C.S. Shinaberger, S. Greenland, J.D. Kopple, D. Van Wyck, R. Mehrotra, C.P. Kovesdy, et al.Is controlling phosphorus by decreasing dietary protein intake beneficial or harmful in persons with chronic kidney disease?. Am J Clin Nutr., 88 (2008), pp. 1511-1518 http://dx.doi.org/10.3945/ajcn.2008.26665 | Medline
- T.A. Ikizler, J.D. Burrowes, L.D. Byham-Gray, K.L. Campbell, J.J. Carrero, W. Chan, et al.KDOQI Clinical Practice Guideline for Nutrition in CKD: 2020 Update. Am J Kidney Dis., 76 (2020), pp. S1-S107
- S.M. Moe, M.P. Zidehsarai, M.A. Chambers, L.A. Jackman, J.S. Radcliffe, L.L. Trevino, et al.Vegetarian compared with meat dietary protein source and phosphorus homeostasis in chronic kidney disease. Clin J Am Soc Nephrol., 6 (2011), pp. 257-264 http://dx.doi.org/10.2215/CJN.05040610 | Medline
- F.N. Byrne, B.A. Gillman, M. Kiely, B. Palmer, F. Shiely, P.M. Kearney, et al.Pilot Randomized Controlled Trial of a Standard Versus a Modified Low-Phosphorus Diet in Hemodialysis Patients. Kidney Int Rep., 5 (2020), pp. 1945-1955 http://dx.doi.org/10.1016/j.ekir.2020.08.008 | Medline
- A.C. Ross, J.E. Manson, S.A. Abrams, J.F. Aloia, P.M. Brannon, S.K. Clinton, et al.The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine: what clinicians need to know. J Clin Endocrinol Metab., 96 (2011), pp. 53-58 http://dx.doi.org/10.1210/jc.2010-2704 | Medline
- G.A. Block, H.G. Bone, L. Fang, E. Lee, D. Padhi.A single-dose study of denosumab in patients with various degrees of renal impairment. J Bone Miner Res., 27 (2012), pp. 1471-1479
- D.J. Goldsmith.Pro: Should we correct vitamin D deficiency/insufficiency in chronic kidney disease patients with inactive forms of vitamin D or just treat them with active vitamin D forms?. Nephrol Dial Transplant., 31 (2016), pp. 698-705 http://dx.doi.org/10.1093/ndt/gfw082 | Medline
- R. Agarwal, P.I. Georgianos.Con: Nutritional vitamin D replacement in chronic kidney disease and end-stage renal disease. Nephrol Dial Transplant., 31 (2016), pp. 706-713
- C. Zoccali, F. Mallamaci.Moderator’s view: Vitamin D deficiency treatment in advanced chronic kidney disease: a close look at the emperor’s clothes. Nephrol Dial Transplant., 31 (2016), pp. 714-716
- D.M. Spiegel, K. Brady.Calcium balance in normal individuals and in patients with chronic kidney disease on low- and high-calcium diets. Kidney Int., 81 (2012), pp. 1116-1122 http://dx.doi.org/10.1038/ki.2011.490 | Medline
- K.M. Hill, B.R. Martin, M.E. Wastney, G.P. McCabe, S.M. Moe, C.M. Weaver, et al.Oral calcium carbonate affects calcium but not phosphorus balance in stage 3-4 chronic kidney disease. Kidney Int., 83 (2013), pp. 959-966 http://dx.doi.org/10.1038/ki.2012.403 | Medline
- C. Wang, X. Liu, Y. Zhou, S. Li, Y. Chen, Y. Wang, et al.New Conclusions Regarding Comparison of Sevelamer and Calcium-Based Phosphate Binders in Coronary-Artery Calcification for Dialysis Patients: A Meta-Analysis of Randomized Controlled Trials. PLoS One., 10 (2015 Jul 31), pp. e0133938 http://dx.doi.org/10.1371/journal.pone.0133938 | Medline
- J.F. Navarro-González, C. Mora-Fernández, M. Muros de Fuentes, J. Donate-Correa, J. Cazaña-Pérez, J. García-Pérez.Effect of Phosphate Binders on Serum Inflammatory Profile Soluble CD14, and Endotoxin Levels in Hemodialysis Patients.Clin J Am Soc Nephrol., 6 (2011), pp. 2272-2279 http://dx.doi.org/10.2215/CJN.01650211 | Medline
- L. Rodríguez-Osorio, D.P. Zambrano, C. Gracia-Iguacel, J. Rojas-Rivera, A. Ortiz, J. Egido, et al.Use of sevelamer in chronic kidney disease: beyond phosphorus control. Nefrologia., 35 (2015), pp. 207-217 http://dx.doi.org/10.1016/j.nefro.2015.05.022 | Medline
- J. Navarro-González, C. Mora-Fernández, M. Muros, H. Herrera, J. García.Mineral Metabolism and Inflammation in Chronic Kidney Disease Patients: A Cross-Sectional Study. Clin J Am Soc Nephrol., 4 (2009), pp. 1646-1654 http://dx.doi.org/10.2215/CJN.02420409 | Medline
- G.A. Block, P. Raggi, A. Bellasi, L. Kooienga, D.M. Spiegel.Mortality effect of coronary calcification and phosphate binder choice in incident hemodialysis patients. Kidney Int., 71 (2007), pp. 41-438
- N. Sekercioglu, L. Thabane, J.P. Díaz Martínez, G. Nesrallah, C.J. Longo, J.W. Busse, et al.Comparative Effectiveness of Phosphate Binders in Patients with Chronic Kidney Disease: A Systematic Review and Network Meta-Analysis. PLoS One., 11 (2016), pp. e0156891
- L. Patel, L.M. Bernard, G.J. Elder.Sevelamer Versus Calcium-Based Binders for Treatment of Hyperphosphatemia in CKD: A Meta-Analysis of Randomized Controlled Trials. Clin J Am Soc Nephrol., 11 (2016), pp. 232-244
- S.C. Palmer, S. Gardner, M. Tonelli, D. Mavridis, D.W. Johnson, J.C. Craig, et al.Phosphate-Binding Agents in Adults With CKD: A Network Meta-analysis of Randomized Trials. Am J Kidney Dis., 68 (2016), pp. 691-702
- M.P. Curran, D.M. Robinson.Lanthanum carbonate: a review of its use in lowering serum phosphate in patients with end-stage renal disease. Drugs., 69 (2009), pp. 2329-2349 http://dx.doi.org/10.2165/11202610-000000000-00000 | Medline
- R. Wilson, P. Zhang, M. Smyth, R. Pratt.Assessment of survival in a 2-year comparative study of lanthanum carbonate versus standard therapy. Curr Med Res Opin., 25 (2009), pp. 3021-3028 http://dx.doi.org/10.1185/03007990903399398 | Medline
- F. Wang, X. Lu, J. Zhang, R. Xiong, H. Li, S. Wang.Effect of Lanthanum Carbonate on All-Cause Mortality in Patients Receiving Maintenance Hemodialysis: a Meta-Analysis of Randomized Controlled Trials. Kidney Blood Press Res., 43 (2018), pp. 536-544 http://dx.doi.org/10.1159/000488700 | Medline
- A.L.M. de Francisco, M. Leidig, A.C. Covic, M. Ketteler, E. Benedyk-Lorens, G.M. Mircescu, et al.Evaluation of calcium acetate/magnesium carbonate as a phosphate binder compared with sevelamer hydrochloride in haemodialysis patients: a controlled randomized study (CALMAG study) assessing efficacy and tolerability. Nephrol Dial Transplant., 25 (2010), pp. 3707-3717 http://dx.doi.org/10.1093/ndt/gfq292 | Medline
- D.M. Spiegel, B. Farmer.Long-term effects of magnesium carbonate on coronary artery calcification and bone mineral density in hemodialysis patients: a pilot study. Hemodial Int., 13 (2009), pp. 453-459 http://dx.doi.org/10.1111/j.1542-4758.2009.00364.x | Medline
- I.P. Tzanakis, E.E. Stamataki, A.N. Papadaki, N. Giannakis, N.E. Damianakis, D.G. Oreopoulos.Magnesium retards the progress of the arterial calcifications in hemodialysis patients: a pilot study. Int Urol Nephrol., 46 (2014), pp. 2199-2205 http://dx.doi.org/10.1007/s11255-014-0751-9 | Medline
- Z.A. Massy, I. Nistor, M. Apetrii, V.M. Brandenburg, J. Bover, P. Evenepoel, et al.Magnesium-based interventions for normal kidney function and chronic kidney disease. Magnes Res., 29 (2016), pp. 126-140 http://dx.doi.org/10.1684/mrh.2016.0412 | Medline
- Y. Sakaguchi, T. Hamano, Y. Isaka.Effects of Magnesium on the Phosphate Toxicity in Chronic Kidney Disease: Time for Intervention Studies. Nutrients., 9 (2017), pp. 112
- S.M. Sprague, J. Floege.
Sucroferric oxyhydroxide for the treatment of hyperphosphatemia.Expert Opin Pharmacother., 19 (2018), pp. 1137-1148 http://dx.doi.org/10.1080/14656566.2018.1491548 | Medline
- J. Bover, J.F. Navarro-González, M.D. Arenas, J-V. Torregrosa, J. Tamargo Menéndez, A.L. Martín de Francisco, et al.Pharmacological interactions of phosphate binders. Nefrologia., 38 (2018), pp. 573-578
- M.D. Arenas, T. Malek, F. Álvarez-Ude, M.T. Gil, A. Moledous, A. Reig-Ferrer.Captores del fósforo: preferencias de los pacientes en hemodiálisis y su repercusión sobre el cumplimiento del tratamiento y el control del fósforo. Nefrologia., 30 (2010), pp. 522-530 http://dx.doi.org/10.3265/Nefrologia.pre2010.may.10275 | Medline
- J.B. Cannata-Andía, J.L. Fernández-Martín, F. Locatelli, G. London, J.L. Gorriz, J. Floege, et al.Use of phosphate-binding agents is associated with a lower risk of mortality. Kidney Int., 84 (2013), pp. 998-1008 http://dx.doi.org/10.1038/ki.2013.185 | Medline
- T. Isakova, O.M. Gutiérrez, Y. Chang, A. Shah, H. Tamez, K. Smith, et al.Phosphorus binders and survival on hemodialysis. J Am Soc Nephrol., 20 (2009), pp. 388-396 http://dx.doi.org/10.1681/ASN.2008060609 | Medline
- S.A. Jamal, B. Vandermeer, P. Raggi, D.C. Mendelssohn, T. Chatterley, M. Dorgan, et al.Effect of calcium-based versus non-calcium-based phosphate binders on mortality in patients with chronic kidney disease: an updated systematic review and meta-analysis. Lancet., 382 (2013), pp. 1268-1277 http://dx.doi.org/10.1016/S0140-6736(13)60897-1 | Medline
- G.A. Block, D.C. Wheeler, M.S. Persky, B. Kestenbaum, M. Ketteler, D.M. Spiegel, et al.Effects of phosphate binders in moderate CKD. J Am Soc Nephrol., 23 (2012), pp. 1407-1415 http://dx.doi.org/10.1681/ASN.2012030223 | Medline
- N.D. Toussaint, E. Pedagogos, N.M. Lioufas, G.J. Elder, E.M. Pascoe, S.V. Badve, et al.A Randomized Trial on the Effect of Phosphate Reduction on Vascular End Points in CKD (IMPROVE-CKD). J Am Soc Nephrol., 31 (2020), pp. 2653-2666 http://dx.doi.org/10.1681/ASN.2020040411 | Medline
- J.H. Ix, T. Isakova, B. Larive, K.L. Raphael, D.S. Raj, A.K. Cheung, et al.Effects of Nicotinamide and Lanthanum Carbonate on Serum Phosphate and Fibroblast Growth Factor-23 in CKD: The COMBINE Trial. J Am Soc Nephrol., 30 (2019), pp. 1096-1108 http://dx.doi.org/10.1681/ASN.2018101058 | Medline
- J.B. Cannata, J.B. Diaz López.Insights into the complex aluminium and iron relationship. Nephrol Dial Transplant., 6 (1991), pp. 605-607 http://dx.doi.org/10.1093/ndt/6.9.605 | Medline
- A. Dusso, E.A. González, K.J. Martin.Vitamin D in chronic kidney disease. Best Pract Res Clin Endocrinol Metab., 25 (2011), pp. 647-655 http://dx.doi.org/10.1016/j.beem.2011.05.005 | Medline
- A.B. Shoben, K.D. Rudser, I.H. de Boer, B. Young, B. Kestenbaum.Association of oral calcitriol with improved survival in nondialyzed CKD. Am Soc Nephrol., 19 (2008), pp. 1613-1619
- C.P. Kovesdy, S. Ahmadzadeh, J.E. Anderson, K. Kalantar-Zadeh.Association of activated vitamin D treatment and mortality in chronic kidney disease. Arch Intern Med., 25 168 (2008), pp. 397-403
- S. Sugiura, D. Inaguma, A. Kitagawa, M. Murata, Y. Kamimura, S. Sendo, et al.Administration of alfacalcidol for patients with predialysis chronic kidney disease may reduce cardiovascular disease events. Clin Exp Nephrol., 14 (2010), pp. 43-50 http://dx.doi.org/10.1007/s10157-009-0233-z | Medline
- A. Cardus, S. Panizo, E. Parisi, E. Fernandez, J.M. Valdivielso.Differential effects of vitamin D analogs on vascular calcification. J Bone Miner Res., 22 (2007), pp. 860-866 http://dx.doi.org/10.1359/jbmr.070305 | Medline
- M. Mizobuchi, J.L. Finch, D.R. Martin, E. Slatopolsky.Differential effects of vitamin D receptor activators on vascular calcification in uremic rats. Kidney Int., 72 (2007), pp. 709-715 http://dx.doi.org/10.1038/sj.ki.5002406 | Medline
- J.M. Martínez-Moreno, J.R. Muñoz-Castañeda, C. Herencia, A.M. Oca, J.C. Estepa, R. Canalejo, et al.In vascular smooth muscle cells paricalcitol prevents phosphate-induced Wnt/(-catenin F activation. Am J. Physiol Renal Physiol., 303 (2012), pp. F1136-F1144 http://dx.doi.org/10.1152/ajprenal.00684.2011 | Medline
- D. de Zeeuw, R. Agarwal, M. Amdahl, P. Audhya, D. Coyne, T. Garimella, et al.Selective vitamin D receptor activation with paricalcitol for reduction of albuminuria in patients with type 2 diabetes (VITAL study): a randomised controlled trial. Lancet., 376 (2010), pp. 1543-1551 http://dx.doi.org/10.1016/S0140-6736(10)61032-X | Medline
- Y.C. Li, J. Kong, M. Wei, Z.F. Chen, S.Q. Liu, L-P. Cao.1,25-Dihydroxyvitamin D(3) is a negative endocrine regulator of the renin-angiotensin system. J Clin Invest., 110 (2002), pp. 229-238 http://dx.doi.org/10.1172/JCI15219 | Medline
- M. Teng, M. Wolf, M.N. Ofsthun, J.M. Lazarus, M.A. Hernán, C.A. Camargo Jr., et al.Activated injectable vitamin D and hemodialysis survival: a historical cohort study. J Am Soc Nephrol., 16 (2005), pp. 1115-1125 http://dx.doi.org/10.1681/ASN.2004070573 | Medline
- R.J. Lu, S.M. Zhu, F.L. Tang, X.S. Zhu, Z.D. Fan, G.L. Wang, et al.Effects of vitamin D or its analogues on the mortality of patients with chronic kidney disease: an updated systematic review and meta-analysis. Eur J Clin Nutr., 71 (2017), pp. 683-693
- M. Teng, M. Wolf, E. Lowrie, N. Ofsthun, J.M. Lazarus, R. Thadhani.Survival of patients undergoing hemodialysis with paricalcitol or calcitriol therapy. N Engl J Med., 349 (2003), pp. 446-456 http://dx.doi.org/10.1056/NEJMoa022536 | Medline
- Caravaca F, F. Caravaca-Fontán, L. Azevedo, E. Luna.Changes in renal function after discontinuation of vitamin D analogues in advanced chronic kidney disease. Nefrologia., 38 (2018), pp. 179-189 http://dx.doi.org/10.1016/j.nefro.2017.05.012 | Medline
- R. Thadhani, E. Appelbaum, Y. Pritchett, Y. Chang, J. Wenger, H. Tamez, et al.Vitamin D therapy and cardiac structure and function in patients with chronic kidney disease: the PRIMO randomized controlled trial. JAMA., 307 (2012), pp. 674-684 http://dx.doi.org/10.1001/jama.2012.120 | Medline
- A.Y. Wang, F. Fang, J. Chan, Y.Y. Wen, S. Qing, I.H. Chan, et al.Effect of paricalcitol on left ventricular mass and function in CKD–the OPERA trial. J Am Soc Nephrol., 25 (2014), pp. 175-186 http://dx.doi.org/10.1681/ASN.2013010103 | Medline
- I. Santamaría, I. Álvarez-Hernández, D. Jofré, R. Polo, J.R. Menárguez, J.B. Cannata-Andia.Progression of secondary hyperparathyroidism involves deregulation of genes related to DNA. RNA. Santamaria stability. Kidney Int., 67 (2005), pp. 2267-2279
- I. Santamaría, D. Álvarez-Hernández, J.B. Cannata-Andía.Genetic and molecular disorders in severe secondary hiperparathyroidism: Lessons from RNA and microarrays studies. Nephrol., 18 (2005), pp. 469-473
- N. Tabibzadeh, A. Karaboyas, B.M. Robinson, P.A. Csomor, D.M. Spiegel, P. Evenepoel, et al.The risk of medically uncontrolled secondary hyperparathyroidism depends on parathyroid hormone levels at haemodialysis initiation. Nephrol Dial Transplant., 36 (2021), pp. 160-169 http://dx.doi.org/10.1093/ndt/gfaa195 | Medline
- S. Walter, A. Baruch, J. Dong, J.E. Tomlinson, S.T. Alexander, J. Janes, et al.Pharmacology of AMG 416 (Velcalcetide), a novel peptide agonist of the calcium-sensing receptor, for the treatment of secondary hyperparathyroidism in hemodialysis patients. J Pharmacol Exp Ther., 346 (2013), pp. 229-240 http://dx.doi.org/10.1124/jpet.113.204834 | Medline
- G.A. Block, K.J. Martin, A.L. de Francisco, S.A. Turner, M.M. Avram, M.G. Suranyi, et al.Cinacalcet for secondary hyperparathyroidism in patients receiving hemodialysis. N Engl J Med., 350 (2004), pp. 1516-1525 http://dx.doi.org/10.1056/NEJMoa031633 | Medline
- A.L.M. De Francisco.Cinacalcet HCL: a novel therapeutic for hyperparathyroidism. Expert Opin Pharmacother., 6 (2005), pp. 441-452 http://dx.doi.org/10.1517/14656566.6.3.441 | Medline
- N. MIittman, F. Finkelstein, B. Culleton.Cinacalcet HCl (Sensipar™) for the Management of Secondary Hyperparathyroidism (HPT) in Patients Receiving Peritoneal Dialysis (PD). J Am Soc Nephrol, 15 (2004), pp. 280
- G.M. Chertow, S. Blumenthal, S. Turner, M. Roppolo, L. Stern, E.M. Chi, et al.Cinacalcet hydrochloride (Sensipar) in hemodialysis patients on active vitamin D derivatives with controlled PTH and elevated calcium x phosphate. Clin J Am Soc Nephrol., 1 (2006), pp. 305-312 http://dx.doi.org/10.2215/CJN.00870805 | Medline
- J. Bover, R. Perez, M. Molina, B. Benavides, F. Ariza, J.L. Miguel, et al.Cinacalcet Treatment for Secondary Hyperparathyroidism in Dialysis Patients: An Observational Study in Routine Clinical Practice. Nephron Clin Pract., 118 (2010), pp. 109-121
- I. Lopez, F.J. Mendoza, F. Guerrero, Y. Almaden, C. Henley, E. Aguilera-Tejero, et al.The calcimimetic AMG 641 accelerates regression of extraosseous calcification in uremic rats. Am J Physiol Renal Physiol., 296 (2009), pp. F1376-F1385 http://dx.doi.org/10.1152/ajprenal.90737.2008 | Medline
- P.A. Ureña-Torres, J. Floege, C.M. Hawley, E. Pedagogos, W.G. Goodman, F. Pétavy, et al.Protocol adherence and the progression of cardiovascular calcification in the ADVANCE study. Nephrol Dial Transplant., 28 (2013), pp. 146-152
- J. Cunningham, M. Danese, K. Olson, P. Klassen, G.M. Chertow.Effects of the calcimimetic cinacalcet HCl on cardiovascular disease, fracture, and health-related quality of life in secondary hyperparathyroidism. Kidney Int., 68 (2005), pp. 1793-1800 http://dx.doi.org/10.1111/j.1523-1755.2005.00596.x | Medline
- S.M. Moe, S. Abdalla, G.M. Chertow, P.S. Parfrey, G.A. Block, R. Correa-Rotter, et al.Effects of Cinacalcet on Fracture Events in Patients Receiving Hemodialysis: The EVOLVE Trial. J Am Soc Nephrol., 26 (2015), pp. 1466-1475 http://dx.doi.org/10.1681/ASN.2014040414 | Medline
- P.S. Parfrey, T.B. Drüeke, G.A. Block, R. Correa-Rotter, J. Floege, C.A. Herzog, et al.The Effects of Cinacalcet in Older and Younger Patients on Hemodialysis: The Evaluation of Cinacalcet HCl Therapy to Lower Cardiovascular Events (EVOLVE) Trial. Clin J Am Soc Nephrol., 10 (2015), pp. 791-799 http://dx.doi.org/10.2215/CJN.07730814 | Medline
- J. Bover, P. Ureña, C. Ruiz-García, I. daSilva, P. Lescano, J. del Carpio, et al.Clinical and Practical Use of Calcimimetics in Dialysis Patients with Secondary Hyperparathyroidism. Clin J Am Soc Nephrol., 11 (2016), pp. 161-174 http://dx.doi.org/10.2215/CJN.01760215 | Medline
- S. Yamada, M. Tokumoto, M. Taniguchi, J. Toyonaga, T. Suehiro, R. Eriguchi, et al.Two Years of Cinacalcet Hydrochloride Treatment Decreased Parathyroid Gland Volume and Serum Parathyroid Hormone Level in Hemodialysis Patients With Advanced Secondary Hyperparathyroidism. Ther Apher Dial., 19 (2015), pp. 367-377 http://dx.doi.org/10.1111/1744-9987.12292 | Medline
- G.A. Block, D.A. Bushinsky, S. Cheng, J. Cunningham, B. Dehmel, T.B. Drueke, et al.Effect of Etelcalcetide vs Cinacalcet on Serum Parathyroid Hormone in Patients Receiving Hemodialysis With Secondary Hyperparathyroidism: A. Randomized Clinical. Trial JAMA., 317 (2017), pp. 156-164
- M.D. Arenas, C. Rodelo-Haad, M.V.P. de Mier, M. Rodriguez.Control of hyperparathyroidism with the intravenous calcimimetic etelcalcetide in dialysis patients adherent non-adherent to oral calcimimetics. Clin Kidney J., 14 (2020), pp. 840-846 http://dx.doi.org/10.1093/ckj/sfaa005 | Medline
- J.V. Torregrosa, I. Félez, D. Fuster.Usefulness of imaging techniques in secondary hyperparathyroidism. Nefrologia., 30 (2010), pp. 158-167 http://dx.doi.org/10.3265/Nefrologia.pre2010.Jan.10231 | Medline
- A. Ishani, J. Liu, J.B. Wetmore, K.A. Lowe, T. Do, B.D. Bradbury, et al.Clinical Outcomes after Parathyroidectomy in a Nationwide Cohort of Patients on Hemodialysis. Clin J Am Soc Nephrol., 10 (2015), pp. 90-97 http://dx.doi.org/10.2215/CJN.03520414 | Medline
- W.L. Lau, Y. Obi, K. Kalantar-Zadeh.Parathyroidectomy in the Management of Secondary Hyperparathyroidism. Clin J Am Soc Nephrol., 13 (2018), pp. 952-961
- N. Jain, R.F. Reilly.Hungry bone syndrome. Curr Opin Nephrol Hypertens., 26 (2017), pp. 250-255 http://dx.doi.org/10.1097/MNH.0000000000000327 | Medline
- J.E. Witteveen, S. van Thiel, J.A. Romijn, N.A. Hamdy.Hungry bone syndrome: still a challenge in the post-operative management of primary hyperparathyroidism: a systematic review of the literature. Eur J Endocrinol., 168 (2013), pp. R45-R53 http://dx.doi.org/10.1530/EJE-12-0528 | Medline
- R.H. Yenchek, J.H. Ix, M.G. Shlipak, D.C. Bauer, N.J. Rianon, S.B. Kritchevsky, et al.Bone mineral density and fracture risk in older individuals with CKD. Clin J Am Soc Nephrol., 7 (2012), pp. 1130-1136 http://dx.doi.org/10.2215/CJN.12871211 | Medline
- J.V. Torregrosa, A.M. Ramos.Use of bisphosphonates in chronic kidney disease. Nefrologia., 30 (2010), pp. 288-296 http://dx.doi.org/10.3265/Nefrologia.pre2010.Apr.10320 | Medline
- D.A. Hanley, J.D. Adachi, A. Bell, V. Brown.Denosumab: mechanism of action and clinical outcomes. Int J Clin Pract., 66 (2012), pp. 1139-1146 http://dx.doi.org/10.1111/ijcp.12022 | Medline
- R. Jalleh, G. Basu, R. Le Leu, S. Jesudason.Denosumab-Induced Severe Hypocalcaemia in Chronic Kidney Disease. Case Rep Nephrol., 2018 (2018), pp. 7384763
- S.R. Cummings, S. Ferrari, R. Eastell, N. Gilchrist, J.E. Beck Jensen, M. McClung, et al.Vertebral Fractures After Discontinuation of Denosumab: A Post Hoc Analysis of the Randomized Placebo-Controlled FREEDOM Trial and Its Extension. J Bone Miner Res., 33 (2018), pp. 190-198 http://dx.doi.org/10.1002/jbmr.3337 | Medline
- S. Ferrari, C. Libanati, L. Cjf, J.P. Brown, F. Cosman, E. Czerwiński, et al.Relationship Between Bone Mineral Density T-score and Nonvertebral Fracture Risk Over 10 Years of Denosumab Treatment. J Bone Miner Res., 34 (2019), pp. 1033-1040 http://dx.doi.org/10.1002/jbmr.3722 | Medline
- H.G. Bone, R.B. Wagman, M.L. Brandi, J.P. Brown, R. Chapurlat, S.R. Cummings, et al.10 years of denosumab treatment in postmenopausal women with osteoporosis: results from the phase 3 randomised FREEDOM trial and open-label extension. Lancet Diabetes Endocrinol., 5 (2017), pp. 513-523 http://dx.doi.org/10.1016/S2213-8587(17)30138-9 | Medline
- R.A. Adler, G. El-Hajj Fuleihan, D.C. Bauer, P.M. Camacho, L. Clarke B, G.A. Clines, et al.Managing Osteoporosis in Patients on Long-Term Bisphosphonate Treatment: Report of a Task Force of the American Society for Bone and Mineral Research [published correction appears in J Bone Miner Res 2016 Oct;31(10):1910]. J Bone Miner Res., 31 (2016), pp. 16-35 http://dx.doi.org/10.1002/jbmr.2708 | Medline
- Anexo 1. Ficha Técnica Europea de FORSTEO® Teriparatida. [consultado Abril 2021]. Disponible en: https://www.ema.europa.eu/en/documents/product-information/forsteo-epar-product-information_es.pdf.
- J.D. Kopple, A.S. Levey, T. Greene, W.C. Chumlea, J.J. Gassman, D.L. Hollinger, et al.Effect of dietary protein restriction on nutritional status in the Modification of Diet in Renal Disease Study. Kidney Int., 52 (1997), pp. 778-791 http://dx.doi.org/10.1038/ki.1997.395 | Medline
- M. Rufino, E. de Bonis, M. Martín, S. Rebollo, B. Martín, R. Miquel, et al.Is it possible to control hyperphosphatemia with diet, without inducing protein malnutrition?. Nephrol Dial Transplant., 13 (1998), pp. 65-67 http://dx.doi.org/10.1093/ndt/13.suppl_7.65 | Medline
- I. Martinez, R. Saracho, J. Ocharan, R.J. Muñoz, J. Montenegro.Role of diet in the management of osteodystrophy during progressive renal insufficiency. Nefrologia., 23 (2003), pp. 57-63 Medline
- C. Gómez-Alonso, M.L. Naves-Díaz, J.L. Fernández-Martín, J.B. Díaz-López, M.T. Fernández-Coto, J.B. Cannata-Andía.Vitamin D. status and secondary hyperparathyroidism: The importance of 25-hydroxy vitamin D cut-off levels. Kidney Int Suppl., 63 (2003), pp. S44-S48
- K.D. Cashman, K.M. Seamans, A.J. Lucey, E. Stöcklin, P. Weber, M. Kiely, et al.Relative effectiveness of oral 25-hydroxyvitamin D3 and vitamin D3 in raising wintertime serum 25-hydroxyvitamin D in older adults. Am J Clin Nutr., 95 (2012), pp. 1350-1356 http://dx.doi.org/10.3945/ajcn.111.031427 | Medline
- J.M. Olmos, F. Arnaiz, J.L. Hernández, J.M. Olmos-Martínez, J. González.Calcifediol mensual frente a calcifediol quincenal en el tratamiento de pacientes osteoporóticos. Estudio en la vida real. Rev Osteoporos Metab Miner., 10 (2018), pp. 89-95
- S.M. Sprague, P.W. Crawford, J.Z. Melnick, S.A. Strugnell, S. Ali, R. Mangoo-Karim, et al.Use of Extended-Release Calcifediol to Treat Secondary Hyperparathyroidism in Stages 3 and 4 Chronic Kidney Disease. Am J Nephrol., 44 (2016), pp. 316-325
- H. Reichel.Low-dose alfacalcidol controls secondary hyperparathyroidism in predialysis chronic kidney disease. Nephron Clin Pract, 114 (2010), pp. c268-c276 http://dx.doi.org/10.1159/000276579 | Medline
- J. Bover, P. Ureña-Torres, A.M. Laiz Alonso, J.V. Torregrosa, M. Rodríguez-García, C. Castro-Alonso, et al.Osteoporosis, bone mineral density and CKD-MBD (II): Therapeutic implications. Nefrologia., 39 (2019), pp. 227-242 http://dx.doi.org/10.1016/j.nefro.2018.10.009 | Medline
- S.A. Jamal, O. Ljunggren, C. Stehman-Breen, S.R. Cummings, M.R. McClung, S. Goemaere, et al.Effects of denosumab on fracture and bone mineral density by level of kidney function. J Bone Miner Res., 26 (2011), pp. 1829-1835 http://dx.doi.org/10.1002/jbmr.403 | Medline
- M. Barreto-Lopes, A. Karaboyas, B. Bieber, R.L. Pisoni, S. Walpen, M. Fukagawa, et al.Impact of longer term phosphorus control on cardiovascular mortality in hemodialysis patients using an area under the curve approach: results from the DOPPS. Nephrol Dial Transplant., 35 (2020), pp. 1794-1801 http://dx.doi.org/10.1093/ndt/gfaa054 | Medline
- L. Neri, U. Kreuzberg, F. Bellocchio, D. Brancaccio, C. Barbieri, B. Canaud, et al.Detecting high-risk chronic kidney disease-mineral bone disorder phenotypes among patients on dialysis: a historical cohort study. Nephrol Dial Transplant., 34 (2019), pp. 682-691 http://dx.doi.org/10.1093/ndt/gfy273 | Medline
- D.E. St-Jules, M.R. Rozga, D. Handu, J.J. Carrero.Effect of Phosphate-Specific Diet Therapy on Phosphate Levels in Adults Undergoing Maintenance Hemodialysis: A Systematic Review and Meta-Analysis. Clin J Am Soc Nephrol., 16 (2020), pp. 107-120 http://dx.doi.org/10.2215/CJN.09360620 | Medline
- T.J.K. Koh.Nocturnal hemodialysis: improved quality of life and patient outcomes. Int J Nephrol Renovasc Dis., 12 (2019), pp. 59-68 http://dx.doi.org/10.2147/IJNRD.S165919 | Medline
- S. Achinger, J.C. Ayus.The role of daily dialysis in the control of hyperphosphatemia. Kidney Int Suppl., (2005), pp. S28-S32
- A. Cupisti, M. Gallieni, M.A. Rizzo, S. Caria, M. Meola, P. Bolasco.Phosphate control in dialysis. Int J Nephrol Renovasc Dis., 6 (2013), pp. 193-205 http://dx.doi.org/10.2147/IJNRD.S35632 | Medline
- Y. Isaka, T. Hamano, H. Fujii, Y. Tsujimoto, F. Koiwa, Y. Sakaguchi, et al.Optimal Phosphate Control Related to Coronary Artery Calcification in Dialysis Patients. J Am Soc Nephrol., 32 (2021), pp. 723-735 http://dx.doi.org/10.1681/ASN.2020050598 | Medline
- H. Ogata, M. Fukagawa, H. Hirakata, H. Kaneda, T. Kagimura, T. Akizawa.LANDMARK Study Group. JAMA, 325 (2021), pp. 1946-1954 http://dx.doi.org/10.1001/jama.2021.4807 | Medline
- C. Rodelo-Haad, M.E. Rodríguez-Ortiz, A. Martin-Malo, M.V. Pendon-Ruiz de Mier, M.L. Agüera, J.R. Muñoz-Castañeda, et al.Phosphate control in reducing FGF23 levels in hemodialysis patients. PLoS One., 13 (2018), pp. e0201537
- E. Gonzalez-Parra, M.L. Gonzalez-Casaus, M.D. Arenas, V. Sainz-Prestel, L. Gonzalez-Espinoza, M.A. Muñoz-Rodriguez, et al.Individualization of dialysate calcium concentration according to baseline pre-dialysis serum calcium. Blood Purif., 38 (2014), pp. 224-233 http://dx.doi.org/10.1159/000366126 | Medline
- P. Méndez-Chacón, N. Riccobelli, M.P. Dionisi, E. Sánchez-Álvarez, F. Bardales-Viguria, C. Méndez-Chacón Rodríguez, et al.Bone and mineral metabolism at 55 haemodialysis centres in Lima. Nefrologia., 38 (2018), pp. 279-285
- C. Sánchez, F. López-Barea, J. Sánchez-Cabezudo, A. Bajo, A. Mate, E. Martínez, Multicentre Study Group Collaborators, et al.Low vs standard calcium dialysate in peritoneal dialysis: differences in treatment, biochemistry and bone histomorphometry. A randomized multicentre study. Nephrol Dial Transplant., 19 (2004), pp. 1587-1593
- J. Floege, J. Kim, E. Ireland, C. Chazot, T. Drueke, A. de Francisco, et al.Serum iPTH, calcium and phosphate, and the risk of mortality in a European haemodialysis population. Nephrol Dial Transplant., 26 (2011), pp. 1948-1955 http://dx.doi.org/10.1093/ndt/gfq219 | Medline
- M. Naves-Díaz, J. Passlick-Deetjen, A. Guinsburg, C. Marelli, J.L. Fernández-Martín, D. Rodríguez-Puyol, et al.Calcium, phosphorus, PTH and death rates in a large sample of dialysis patients from Latin America. The CORES Study. Nephrol Dial Transplant., 26 (2011), pp. 1938-1947
- F. Tentori, M. Wang, B.A. Bieber, A. Karaboyas, Y. Li, S.H. Jacobson, et al.Recent changes in therapeutic approaches and association with outcomes among patients with secondary hyperparathyroidism on chronic hemodialysis: the DOPPSstudy. Clin J Am Soc Nephrol., 10 (2015), pp. 98-109 http://dx.doi.org/10.2215/CJN.12941213 | Medline
- M. Rodriguez, M.D. Salmeron, A. Martin-Malo, C. Barbieri, F. Mari, R.I. Molina, et al.A New Data Analysis System to Quantify Associations between Biochemical Parameters of Chronic Kidney Disease-Mineral Bone Disease. PLoS One., 11 (2016), pp. e0146801 http://dx.doi.org/10.1371/journal.pone.0146801 | Medline
- J. Heaf.Adynamic bone disease and malnutrition-inflammation-cachexia syndrome. Kidney Int., 71 (2007), pp. 1326 http://dx.doi.org/10.1038/sj.ki.5002257 | Medline
- D.C. Wheeler, G.M. London, P.S. Parfrey, G.A. Block, R. Correa-Rotter, B. Dehmel, et al.Effects of cinacalcet on atherosclerotic and nonatherosclerotic cardiovascular events in patients receiving hemodialysis: the EValuation Of Cinacalcet HCl Therapy to Lower CardioVascular Events (EVOLVE) trial [published correction appears in J Am Heart Assoc. 2015 Jan;4(1):e000570]. J Am Heart Assoc., 3 (2014), pp. e001363 http://dx.doi.org/10.1161/JAHA.114.001363 | Medline
- J. Floege, Y. Kubo, A. Floege, G.M. Chertow, P.S. Parfrey.The Effect of Cinacalcet on Calcific Uremic Arteriolopathy Events in Patients Receiving Hemodialysis: The EVOLVE Trial. Clin J Am Soc Nephrol., 10 (2015), pp. 800-807 http://dx.doi.org/10.2215/CJN.10221014 | Medline
- D. Goldsmith, A. Covic, M. Vervloet, M. Cozzolino, I. Nistor, Chronic Kidney Disease-Mineral Bone Disease (CKD-MBD) working group and the European Renal Best Practice (ERBP) advisory board.Should patients with CKD stage 5D and biochemical evidence of secondary hyperparathyroidism be prescribed calcimimetic therapy? An ERA-EDTA position statement. Nephrol Dial Transplant., 30 (2015), pp. 698-700 http://dx.doi.org/10.1093/ndt/gfv050 | Medline
- P.J. Matias, C. Ferreira, C. Jorge, M. Borges, I. Aires, T. Amaral, et al.25-Hydroxyvitamin D3, arterial calcifications and cardiovascular risk markers in haemodialysis patients. Nephrol Dial Transplant., 24 (2009), pp. 611-618 http://dx.doi.org/10.1093/ndt/gfn502 | Medline
- P.J. Matias, C. Jorge, C. Ferreira, M. Borges, I. Aires, T. Amaral, et al.Cholecalciferol supplementation in hemodialysis patients: effects on mineral metabolism, inflammation, and cardiac dimension parameters. Clin J Am Soc Nephrol., 5 (2010), pp. 905-911 http://dx.doi.org/10.2215/CJN.06510909 | Medline
- M. Leifheit-Nestler, A. Grabner, L. Hermann, B. Richter, K. Schmitz, D.C. Fischer, et al.Vitamin D treatment attenuates cardiac FGF23/FGFR4 signaling and hypertrophy in uremic rats. Nephrol Dial Transplant., 32 (2017), pp. 1493-1503 http://dx.doi.org/10.1093/ndt/gfw454 | Medline
- S. Panizo, N. Carrillo-López, M. Naves-Díaz, G. Solache-Berrocal, L. Martínez-Arias, R.R. Rodrigues-Díez, et al.Regulation of miR-29b and miR-30c by vitamin D receptor activators contributes to attenuate uraemia-induced cardiac fibrosis. Nephrol Dial Transplant., 32 (2017), pp. 1831-1840 http://dx.doi.org/10.1093/ndt/gfx060 | Medline
- M. Cozzolino, D. Brancaccio, G. Cannella, P. Messa, L. Gesualdo, M. Marangella, et al.VDRA therapy is associated with improved survival in dialysis patients with serum intact PTH ≤ 150 pg/mL: results of the Italian FARO Survey. Nephrol Dial Transplant., 27 (2012), pp. 3588-3594 http://dx.doi.org/10.1093/ndt/gfs108 | Medline
- G.H. Lee, D. Benner, D.L. Regidor, K. Kalantar-Zadeh.Impact of kidney bone disease and its management on survival of patients on dialysis. J Ren Nutr., 17 (2007), pp. 38-44 http://dx.doi.org/10.1053/j.jrn.2006.07.006 | Medline
- F.J. Mendoza, I. Lopez, R. Canalejo, Y. Almaden, D. Martin, E. Aguilera-Tejero, et al.Direct upregulation of parathyroid calcium-sensing receptor and vitamin D receptor by calcimimetics in uremic rats. Am J Physiol Renal Physiol., 296 (2009), pp. F605-F613
- I. Lopez, F.J. Mendoza, E. Aguilera-Tejero, J. Perez, F. Guerrero, D. Martin, et al.The effect of calcitriol, paricalcitol, and a calcimimetic on extraosseous calcifications in uremic rats. Kidney Int., 73 (2008), pp. 300-307
- M. Ketteler, K.J. Martin, M. Wolf, M. Amdahl, M. Cozzolino, D. Goldsmith, et al.Paricalcitol versus cinacalcet plus low-dose vitamin D therapy for the treatment of secondary hyperparathyroidism in patients receiving haemodialysis: results of the IMPACT SHPT study. Nephrol Dial Transplant., 27 (2012), pp. 3270-3278 http://dx.doi.org/10.1093/ndt/gfs018 | Medline
- P.T. Taweesedt, S. Disthabanchong.Mineral and bone disorder after kidney transplantation. World J Transplant., 5 (2015), pp. 231-242 http://dx.doi.org/10.5500/wjt.v5.i4.231 | Medline
- A. Torres, A.P. Rodriguez, M.T. Concepcion, S. Garcia, M. Rufino, B. Martin, et al.Parathyroid function in long-term renal transplant patients: importance of pre-transplant PTH concentrations. Nephrol Dial Transplant., 13 (1998), pp. 94-97
- A. Bouquegneau, S. Salam, P. Delanaye, R. Eastell, A. Khwaja.Bone Disease after Kidney Transplantation. Clin J Am Soc Nephrol., 11 (2016), pp. 1282-1296 http://dx.doi.org/10.2215/CJN.11371015 | Medline
- O.I. Egbuna, J.G. Taylor, D.A. Bushinsky, M.S. Zand.Elevated calcium phosphate product after renal transplantation is a risk factor for graft failure. Clin Transplant., 21 (2007), pp. 558-566
- P. Evenepoel, M. Naesens, K. Claes, D. Kuypers, Y. Vanrenterghem.Tertiary ‘hyperphosphatoninism’ accentuates hypophosphatemia and suppresses calcitriol levels in renal transplant recipients. Am J Transplant., 7 (2007), pp. 1193-1200 http://dx.doi.org/10.1111/j.1600-6143.2007.01753.x | Medline
- W. Gwinner, S. Suppa, M. Mengel, L. Hoy, H.H. Kreipe, H. Haller, et al.Early calcification of renal allografts detected by protocol biopsies: causes and clinical implications. Am J Transplant, 5 (2005), pp. 1934-1941 http://dx.doi.org/10.1111/j.1600-6143.2005.00938.x | Medline
- F. Triponez, O.H. Clark, Y. Vanrenthergem, P. Evenepoel.Surgical treatment of persistent hyperparathyroidism after renal transplantation. Ann Surg., 248 (2008), pp. 18-30 http://dx.doi.org/10.1097/SLA.0b013e3181728a2d | Medline
- J.M. Cruzado, P. Moreno, J.V. Torregrosa, O. Taco, R. Mast, C. Gómez-Vaquero, et al.A Randomized Study Comparing Parathyroidectomy with Cinacalcet for Treating Hypercalcemia in Kidney Allograft Recipients with Hyperparathyroidism. J Am Soc Nephrol., 27 (2016), pp. 2487-2494 http://dx.doi.org/10.1681/ASN.2015060622 | Medline
- A.L. Serra, R. Savoca, A.R. Huber, U. Hepp, A. Delsignore, M. Hersberger, et al.Effective control of persistent hyperparathyroidism with cinacalcet in renal allograft recipients. Nephrol Dial Transplant., 22 (2007), pp. 577-583 http://dx.doi.org/10.1093/ndt/gfl560 | Medline
- R. Delos Santos, A. Rossi, D. Coyne, T.T. Maw.Management of Post-transplant Hyperparathyroidism and Bone Disease. Drugs., 79 (2019), pp. 501-513 http://dx.doi.org/10.1007/s40265-019-01074-4 | Medline
- U. Thiem, A. Gessl, K. Borchhardt.Long-term clinical practice experience with cinacalcet for treatment of hypercalcemic hyperparathyroidism after kidney transplantation. Biomed Res Int., 2015 (2015), pp. 292654
- C. Bergua, J.V. Torregrosa, D. Fuster, A. Gutierrez-Dalmau, F. Oppenheimer, J.M. Campistol.Effect of cinacalcet on hypercalcemia and bone mineral density in renal transplanted patients with secondary hyperparathyroidism. Transplantation., 86 (2008), pp. 413-417 http://dx.doi.org/10.1097/TP.0b013e31817c13e1 | Medline
- A. Torres, V. Lorenzo, E. Salido.Calcium metabolism and skeletal problems after transplantation. J Am Soc Nephrol., 13 (2002), pp. 551-558
- J. Cunningham.Pathogenesis and prevention of bone loss in patients who have kidney disease and receive long-term immunosuppression. J Am Soc Nephrol., 18 (2007), pp. 223-234 http://dx.doi.org/10.1681/ASN.2006050427 | Medline
- L.M. Vautour, L.J. Melton 3rd, B.L. Clarke, S.J. Achenbach, A.L. Oberg, J.T. McCarthy.Long-term fracture risk following renal transplantation: a population-based study. Osteoporos Int., 15 (2004), pp. 160-167 http://dx.doi.org/10.1007/s00198-003-1532-y | Medline
- L.E. Nikkel, C.S. Hollenbeak, E.J. Fox, T. Uemura, N. Ghahramani.Risk of fractures after renal transplantation in the United States. Transplantation., 87 (2009), pp. 1846-1851 http://dx.doi.org/10.1097/TP.0b013e3181a6bbda | Medline
- S.C. Palmer, E.Y. Chung, D.O. McGregor, F. Bachmann, G.F. Strippoli.Interventions for preventing bone disease in kidney transplant recipients. Cochrane Database Syst Rev., 10 (2019), pp. CD005015 http://dx.doi.org/10.1002/14651858.CD005015.pub4 | Medline
- A. Torres, S. García, A. Gómez, A. González, Y. Barrios, M.T. Concepción, et al.Treatment with intermittent calcitriol and calcium reduces bone loss after renal transplantation. Kidney Int., 65 (2004), pp. 705-712 http://dx.doi.org/10.1111/j.1523-1755.2004.00432.x | Medline
- R.G. De Sevaux, A.J. Hoitsma, F.H. Corstens, J.F.M. Wetzels.Treatment with vitamin D y calcium reduces bone loss after renal transplantation: A randomized study. J Am Soc Nephrol., 13 (2002), pp. 1608-1614 http://dx.doi.org/10.1097/01.asn.0000016082.70875.36 | Medline
- A.E. El-Agroudy, A.A. El-Husseini, M. El-Sayed, M.A. Ghoneim.Preventing bone loss in renal transplant recipients with vitamin D. J Am Soc Nephrol., 14 (2003), pp. 2975-2979 http://dx.doi.org/10.1097/01.asn.0000093255.56474.b4 | Medline
- M.A. Josephson, L.P. Schumm, M.Y. Chiu, C. Marshall, J.R. Thistlethwaite, S.M. Sprague.Calcium and calcitriol prophylaxis attenuates posttransplant bone loss. Transplantation., 78 (2004), pp. 1233-1236 http://dx.doi.org/10.1097/01.tp.0000137937.44703.42 | Medline
- G. Cianciolo, A. Galassi, I. Capelli, M.L. Angelini, G. La Manna, M. Cozzolino.Vitamin D in Kidney Transplant Recipients: Mechanisms and Therapy. Am J Nephrol., 43 (2016), pp. 397-407
- J.V. Torregrosa, D. Fuster, S. Pedroso, F. Diekmann, J.M. Campistol, S. Rubí, et al.Weekly risedronate in kidney transplant patients with osteopenia. Transpl Int., 20 (2007), pp. 708-711 http://dx.doi.org/10.1111/j.1432-2277.2007.00501.x | Medline
- N.D. Toussaint, G.J. Elder, P.G. Kerr.Bisphosphonates in chronic kidney disease; balancing potential benefits and adverse effects on bone and soft tissue.Clin J Am Soc Nephrol., 4 (2009), pp. 221-233http://dx.doi.org/10.2215/CJN.02550508 | Medline
- M. Coco, D. Glicklich, M.C. Faugere, L. Burris, I. Bognar, P. Durkin, et al.Prevention of Bone Loss in Renal Transplant Recipients: A prospective, randomized trial of intravenous pamidronate.J Am Soc Nephrol., 14 (2003), pp. 2669-2676http://dx.doi.org/10.1097/01.asn.0000087092.53894.80 | Medline
- W. Grotz, Nagel Ch, D. Poeschel, M. Cybulla, K.G. Petersen, M. Uhl, et al.Effect of Ibandronate on Bone Loss and Renal Function after Kidney Transplantation. J Am Soc Nephrol., 12 (2001), pp. 1530-1537 http://dx.doi.org/10.1681/ASN.V1271530 | Medline
- J.V. Torregrosa, A. Moreno, A. Gutierrez, S. Vidal, F. Oppenheimer.Alendronate for treatment of renal transplant patients with osteoporosis. Transplant Proc., 35 (2003), pp. 1393-1395 http://dx.doi.org/10.1016/s0041-1345(03)00479-2 | Medline
- J.V. Torregrosa, D. Fuster, M.A. Gentil, R. Marcen, L. Guirado, S. Zarraga, et al.Open-label trial: effect of weekly risedronate immediately after transplantation in kidney recipients. Transplantation., 89 (2010), pp. 1476-1481 http://dx.doi.org/10.1097/TP.0b013e3181dc13d0 | Medline
- J.V. Torregrosa, D. Fuster, A. Monegal, M.A. Gentil, J. Bravo, L. Guirado, et al.Efficacy of low doses of pamidronate in osteopenic patients administered in the early post-renal transplant. Osteoporos Int., 22 (2011), pp. 281-287 http://dx.doi.org/10.1007/s00198-010-1197-2 | Medline
- J. Wang, M. Yao, J.H. Xu, B. Shu, Y.J. Wang, X.J. Cui.Bisphosphonates for prevention of osteopenia in kidney-transplant recipients: a systematic review of randomized controlled trials. Osteoporos Int., 27 (2016), pp. 1683-1690 http://dx.doi.org/10.1007/s00198-015-3465-7 | Medline
- S.M. Toth-Manikowski, J.M. Francis, A. Gautam, C.E. Gordon.Outcomes of bisphosphonate therapy in kidney transplant recipients: a systematic review and meta-analysis. Clin Transplant., 30 (2016), pp. 1090-1096 http://dx.doi.org/10.1111/ctr.12792 | Medline
- K.L. Naylor, G. Zou, W.D. Leslie, A.B. Hodsman, N.N. Lam, E. McArthur, et al.Risk factors for fracture in adult kidney transplant recipients. World J Transplant., 6 (2016), pp. 370-379 http://dx.doi.org/10.5500/wjt.v6.i2.370 | Medline
- K.L. Naylor, W.D. Leslie, A.B. Hodsman, D.N. Rush, A.X. Garg.FRAX predicts fracture risk in kidney transplant recipients. Transplantation., 97 (2014), pp. 940-945 http://dx.doi.org/10.1097/01.TP.0000438200.84154.1a | Medline
- M. Luckman, D. Hans, N. Cortez, K.K. Nishiyama, S. Agarawal, C. Zhang, et al.Spine Trabecular Bone Score as an Indicator of Bone Microarchitecture at the Peripheral Skeleton in Kidney Transplant Recipients. Clin J Am Soc Nephrol., 12 (2017), pp. 644-652
- J. Brunova, S. Kratochvilova, J. Stepankova.Osteoporosis Therapy with Denosumab in Organ Transplant Recipients. Front Endocrinol (Lausanne)., 9 (2018), pp. 162 http://dx.doi.org/10.3389/fendo.2018.00162 | Medline
- M. Bonani, D. Frey, J. Brockmann, T. Fehr, T.F. Mueller, L. Saleh, et al.Effect of Twice-Yearly Denosumab on Prevention of Bone Mineral Density Loss in De Novo Kidney Transplant Recipients: A Randomized Controlled Trial. Am J Transplant., 16 (2016), pp. 1882-1891 http://dx.doi.org/10.1111/ajt.13692 | Medline
- M. Bonani, D. Frey, O. de Rougemont, N.J. Mueller, T.F. Mueller, N. Graf, et al.Infections in De Novo Kidney Transplant Recipients Treated With the RANKL Inhibitor Denosumab. Transplantation., 101 (2017), pp. 2139-2145 http://dx.doi.org/10.1097/TP.0000000000001547 | Medline
- K. Sumida, Y. Ubara, J. Hoshino, K. Mise, N. Hayami, T. Suwabe, et al.Once-weekly teriparatide in hemodialysis patients with hypoparathyroidism and low bone mass: a prospective study. Osteoporos Int., 27 (2016), pp. 1441-1450 http://dx.doi.org/10.1007/s00198-015-3377-6 | Medline
Copyright © 2022. Sociedad Española de Nefrología
Autores
Revista Nefrología
Nefrología es la publicación oficial de la Sociedad Española de Nefrología. La revista publica artículos sobre investigación básica o clínica relacionada con la nefrología, la hipertensión arterial, la diálisis y el trasplante de riñón.
- Revista Nefrología#molongui-disabled-link
- Revista Nefrología#molongui-disabled-link
- Revista Nefrología#molongui-disabled-link
- Revista Nefrología#molongui-disabled-link

