Obesidad y menopausia
Para las mujeres de 55 a 65 años, el aumento de peso es uno de los problemas más importantes de salud(1). Los efectos nocivos de la obesidad son diversos y van desde un mayor riesgo de muerte prematura hasta varias enfermedades no mortales pero con un impacto negativo en la calidad de vida.
La obesidad es un factor de riesgo importante para la diabetes mellitus, la enfermedad arterial coronaria, infarto del miocardio, accidente cerebrovascular e hipertensión arterial sistémica(2,3).
En general, la obesidad es más prevalente en las mujeres que en hombres y se han propuesto varias teorías para explicarlo, sin embargo ninguna ha sido concluyente. Las fluctuaciones de las hormonas sexuales en diferentes etapas de la vida reproductiva como la menstruación, el embarazo y la transición de la menopausia, pueden jugar un papel en la expansión del tejido adiposo.(4)
La transición de la menopausia empieza cuando aparecen menstruaciones irregulares y termina con la última menstruación.(4) La menopausia es un proceso biológico caracterizado por el cese del ciclo menstrual en mujeres, aparece entre los 40 y 60 años, pero en promedio se observa a los 51 años (5).
La edad produce aumento estable de peso que en promedio es de 0,5 Kg /año, pero el aumento del índice de andrógenos libres, la disminución de la globulina ligadora de hormonas sexuales, la menopausia quirúrgica y el uso de la terapia hormonal temprana aumentan la incidencia de obesidad y de obesidad severa, así quedó demostrado en el estudio de carácter multiétnico de la Salud de la Mujer en los Estados Unidos(6).
La menopausia es un fenómeno de envejecimiento en las mujeres, etapa que se acompaña de inactividad física y disminución en el metabolismo de la energía asociada con el aumento de la ingesta de alimentos, lo que contribuye al aumento de peso.
La alteración de la composición corporal y la distribución de la grasa en la fase inicial de la menopausia puede ser atribuida a la edad; además se ha encontrado que un incremento del riesgo cardiovascular ocurre en esta etapa de la vida. La obesidad en la menopausia sigue siendo tema de debate: algunos estudios plantean que se explica por los cambios metabólicos debido a que los estrógenos disminuyen en la transición menopáusica, y otros alegan que es solo la consecuencia del envejecimiento y del estilo de vida sedentario(7).
Las alteraciones hormonales durante la transición de la menopausia contribuyen más a los cambios en la distribución de grasa corporal que en la obesidad general, y se ha demostrado que el aumento de la grasa abdominal es influenciado por la disminución de estrógenos y el incremento de andrógenos (8).
Se ha observado que hay 49% de aumento en la grasa abdominal y 22% de incremento de la grasa subcutánea en las mujeres en la etapa posmenopáusica en comparación con las mujeres premenopáusicas lo que sugiere que el último cambio después de la menopausia se asocia con obesidad ligada a una alta proporción de la masa de grasa corporal y la adiposidad central(9).
Entendiendo el aumento de peso en la menopausia
Los estudios en ratones han demostrado que la pérdida de la función ovárica promueve aumento de la masa de tejido adiposo independiente de la dieta.(10,11)
Varios estudios describen que ratones hembras, después de la ooforectomía, presentan una disminución del gasto energético, sin cambios en el consumo de energía, lo que resulta en la hipertrofia de adipocitos, inflamación y desarrollo de hígado graso(10). Sin embargo, cuando se complementa con 17 β-estradiol a las ratones hembras ooforectomizadas están protegidas de desarrollar esteatosis hepática y resistencia a la insulina. En este modelo experimental el suplemento de estradiol también protege de la hipertrofia de los adipocitos del tejido adiposo y del estrés oxidativo.(11)
El estrógeno es un efector importante para la regulación del balance de energía, el peso corporal, la distribución de grasa, y el apetito en ratones.(12,13,14)
Los estrógenos ejercen sus efectos fisiológicos a través de dos receptores de estrógeno (ER) que pertenecen a la familia de receptores nucleares de transcripción activados por ligandos. ERα se expresa principalmente en los tejidos reproductivos, riñones, huesos, tejido adiposo blanco e hígado, mientras que ERβ se expresa en los ovarios, próstata, pulmón, tracto gastrointestinal, vejiga, células hematopoyéticas y sistema nervioso central (CNS).(15)
Existen circuitos neuronales que controlan el metabolismo y no está claro cuál de los subtipos de estrógenos (ERα y ERβ) está involucrado. El subtipo de receptor de estrógeno que está implicado en los efectos del estrógeno en la regulación central de la homeostasis de energía es controvertido ya que se ha demostrado que ERα se expresa en el núcleo ventromedial (VMN), núcleo Arcuato (ARC), y el núcleo Paraventricular (PVN). (16,17)
A pesar de que está bien documentado que una interrupción de la señalización en ERα en ratones modificados conduce a un fenotipo obeso, los sitios de acción de los estrógenos y los mecanismos que subyacen a este fenómeno aún no se conocen. Algunos estudios se han enfocado en el receptor de estrógenos alfa en el núcleo ventromedial del hipotálamo, que es un centro clave de la homeostasis energética.
Después de la supresión de la expresión ERα en este núcleo, ratones hembras y ratas desarrollaron un fenotipo característico para síndrome metabólico y marcado por la obesidad, hiperfagia, tolerancia alterada a la glucosa y gasto de energía reducido. Este fenotipo persistió a pesar de los niveles normales de ERα en otras partes del cerebro.
A pesar de un aumento en la ingesta de alimentos precedido al aumento de peso, los datos sugieren que un factor principal de la obesidad en este modelo es probablemente una disminución en el gasto energético debido a cambios en la tasa metabólica basal y la termogénesis inducida por la dieta. Estos hallazgos indican que ERα en el núcleo ventromedial de las neuronas del hipotálamo desempeña un papel esencial en el control de balance de energía y el mantenimiento del peso corporal normal.(18)
Aunque ERα es un factor central en el control de la homeostasis energética, ERβ probablemente juegue también un papel importante. ERβ se expresa en los mismos núcleos hipotalámicos que ERα, sin embargo, a niveles más bajos con la más alta expresión en el PVN. Co-administración de E2 y ERβ anti-sentido oligodesoxinucleótidos (ODN) en el tercer ventrículo del cerebro reduce los efectos estrogénicos inhibidores sobre la ingesta de alimentos en ratas ovariectomizadas.(14)
Otro receptor que ha sido estudiado es el de aromatasa y el remplazo de estradiol en ratones hembras ArKO (ratones knock-out para receptor de aromatasa). Principalmente da como resultado la reducción del volumen de los adipocitos con pocos cambios en los factores que controlan la síntesis de novo de ácidos grasos de adipocitos, lo que sugiere que los cambios en la absorción de los lípidos de la circulación son los principales mecanismos por los que el estradiol regula la acumulación de grasa.(19)
Menopausia, metabolismo de la glucosa y aterosclerosis
Se ha demostrado que ERα está involucrado en el mantenimiento del metabolismo de la glucosa en varios tejidos, incluyendo el hígado, músculo esquelético, tejido adiposo, células pancreáticas β, y CNS (figura n° 1). Polimorfismos en el gen de ERα se han asociado con el desarrollo de la diabetes tipo 2 y síndrome metabólico.(20)
[su_spacer size=”30″]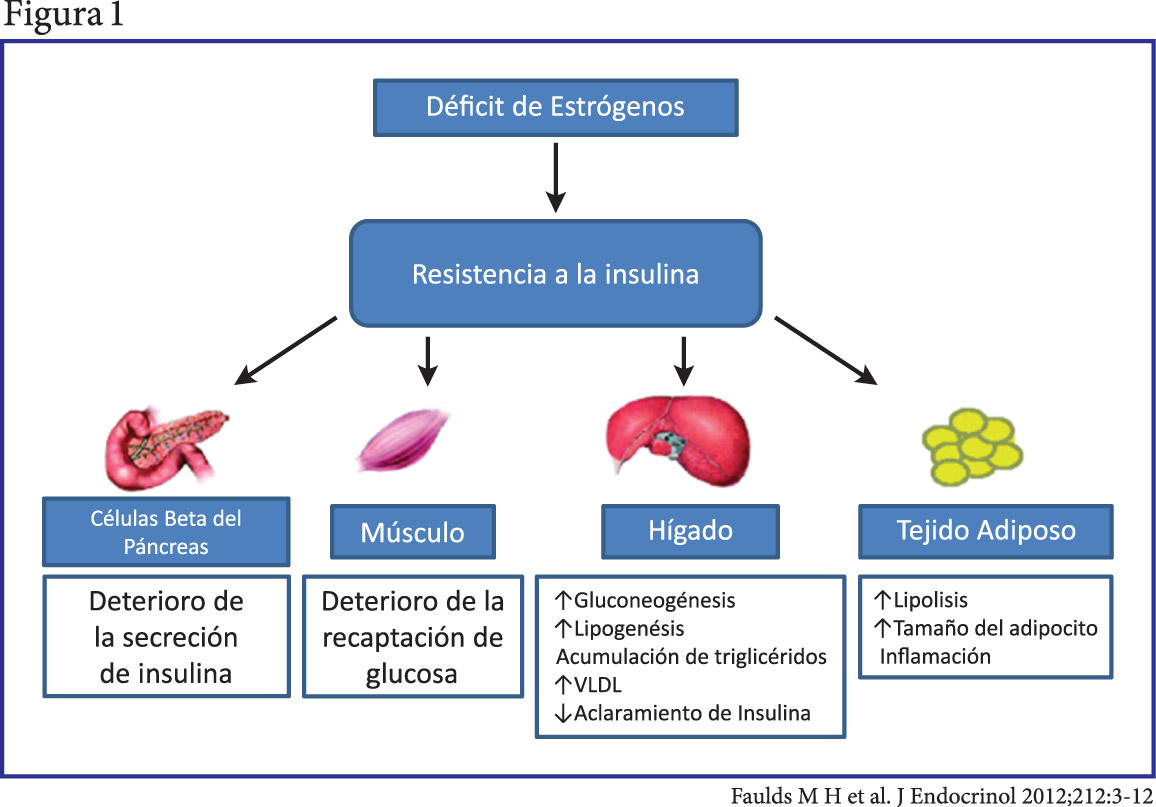 [su_spacer size=”30″]
[su_spacer size=”30″]
El estrógeno ejerce un temprano efecto anti-inflamatorio en el modelo de rata con lesión vascular.(21,22)
La deficiencia de estrógenos en ratas ovariectomizadas se asocia con aumento de los niveles séricos de TNF-alfa.
La administración de inhibidores de TNF o el remplazo E2 se asocia con una disminución de la constricción de las arterias, lo que sugiere que la regulación positiva de TNF durante la deficiencia de estrógeno pueden contribuir a una mayor vasoconstricción.(23)
Cáncer de mama y menopausia
Se han propuesto 3 hipótesis para explicar esta asociación:
- Los estrógenos circulantes periféricos producto de la aromatización de los andrógenos son más altos en las mujeres menopáusica obesas que en las delgadas.
- La obesidad está asociada con el síndrome metabólico. Esto se traduce en aumento de los niveles circulantes de insulina y factor de crecimiento (IGF) que, al actuar como agentes mutagénicos para las células epiteliales de mama, estimulan su crecimiento y degeneración neoplásica.
- La tercera hipótesis sugiere que los adipocitos y sus acciones autocrinas, paracrinas y endocrinas están en el centro de uno de los mecanismos etiopatogénicos (figura n° 2 ).(24)
[su_spacer size=”30″]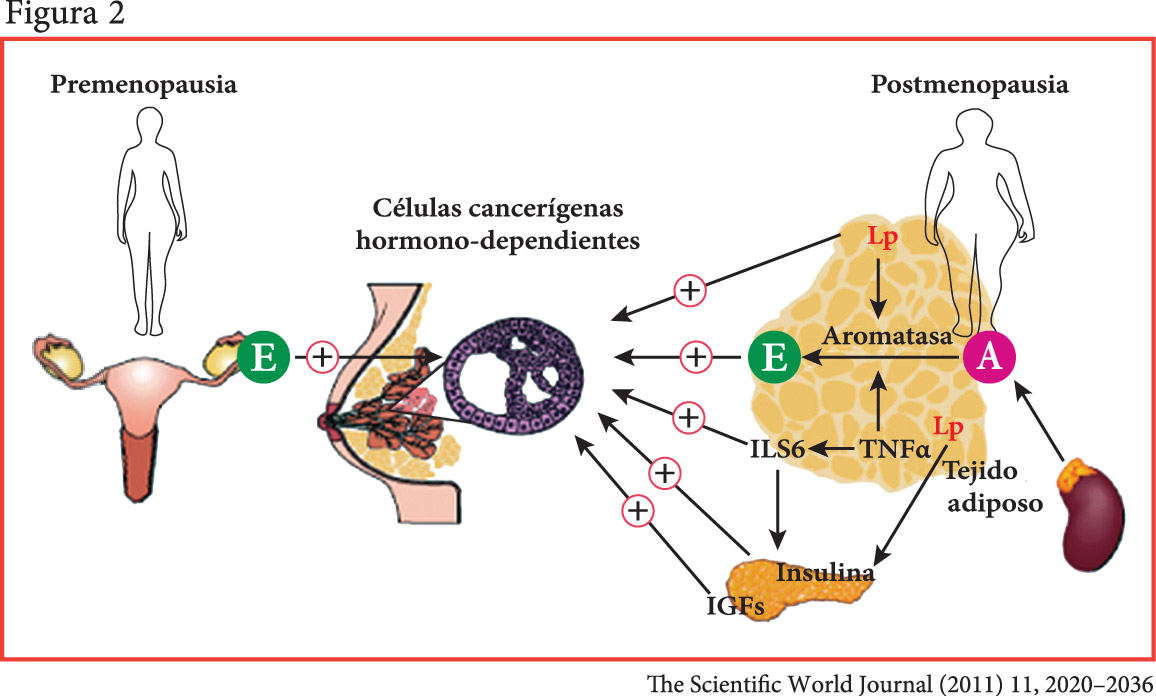 [su_spacer size=”30″]
[su_spacer size=”30″]
La grasa dentro del tejido mamario actúa sinérgicamente con las hormonas ováricas para el desarrollo mamario. Esto puede establecer que existe alguna relación directa del receptor de estrógeno y tejido adiposo con el cáncer de mama. Cuando vemos la otra cara de la moneda, mujeres delgadas jóvenes con cáncer de mama que presentan ER (-) e inmadurez del tejido mamario por déficit de grasa, (figura n° 3).(25)
[su_spacer size=”30″]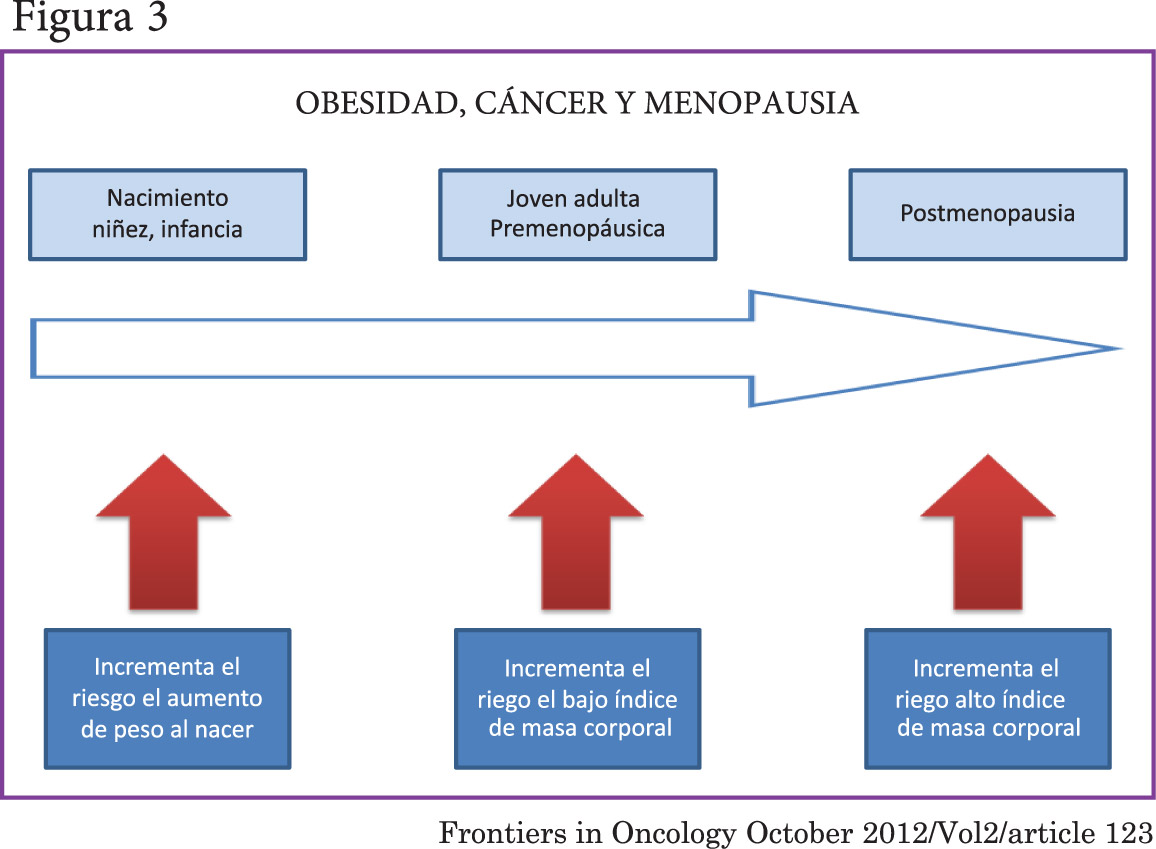 [su_spacer size=”30″]
[su_spacer size=”30″]
Menopausia y osteoporosis
En la década de los 80 la obesidad era relacionada con aumento de la formación ósea y disminución de la resorción, por lo que las mujeres menopáusicas con obesidad podrían tener alguna protección de la pérdida mineral ósea. Investigaciones recientes utilizando marcadores óseos modernos, altamente sensibles y específicos han revelado que la obesidad se asocia con la inhibición de la formación de hueso y la supresión concomitante de la resorción ósea.(26)
La obesidad en la menopausia en una gran proporción es determinada por el peso en la transición menopáusica, preparar a la mujer para esta etapa enfatizando en los cambios de vida es una buena estrategia para evitar las complicaciones cardiometabólicas ya que el uso de terapia hormonal de remplazo requiere una buena evaluación de los riesgos versus los beneficios.
Referencias
- Nappi RE, Kokot-Kierepa M. Vaginal Health: Insights, Views & Attitudes (VIVA) – results from an international survey. Climacteric 2012; 15 : 36 – 44.
- Liu Y, Ding J, Bush TL, Longenecker JC, Nieto FJ, Golden SH, et al. Relative androgen excess and increased cardiovascular risk after menopause: A hypothesized relation. Am J. Epidemiol. 2001; 154: 489–94
- Mosca L, Banka CL, Benjamin EJ, Berra K, Bushnell C, Dolor RJ, et al. Evidence-based guidelines for cardiovascular disease in women prevention. Circulation. 2007;115:1481–501
- Davis SR, Castelo-Branco C, Chedraui P, Lumsden MA, Nappi RE, Shah D, Villaseca P; Writing Group of the International Menopause Society for World Menopause Day 2012.Climacteric. 2012 Oct;15(5):419-29
- Kok HS, van Asselt KM, van der Schouw YT, Peeters PH, Wijmenga C. Genetic studies to identify genes underlying menopausal age. Hum Reprod Update. 2005;11:483–93
- Sutton-Tyrrell K, Zhao X, Santoro N, Lasley B, Sowers M, Johnston J, Mackey R, Matthews K.Reproductive hormones and obesity: 9 years of observation from the Study of Women’s Health Across the Nation. Am J Epidemiol. 2010 Jun 1; 171(11): 1203-13
- Dasgupta S, Salman M, Lokesh S, Xaviour D, Saheb SY, Prasad BV, Sarkar B. Menopause versus aging: The predictor of obesity and metabolic aberrations among menopausal women of Karnataka, South India. J Midlife Health. 2012 Jan; 3(1): 24-30.
- Poehlman RT, Toth MJ, Gardner AW. Changes in energy balance and body composition at menopause: A controlled longitudinal study. Ann Intern Med. 1995;123:673–5
- Toth MJ, Tchernof A, Sites CK, Poehlman ET. Effect of menopausal status on body composition and fat distribution. Int J Obes Relat Metab Disord. 2000;24:226–31
- Rogers NH, Perfield JW 2nd, Strissel KJ, Obin MS, Greenberg AS. Reduced energy expenditure and increased inflammation are early events in the development of ovariectomy-induced obesity.. Endocrinology 2009 ; 150 : 2161 – 8
- Stubbins RE, Najjar K, Holcomb VB, Hong J, Núñez NP. Oestrogen alters adipocyte biology and protects female mice from adipocyte inflammation and insulin resistance. Diabetes Obes Metab 2012 ; 14 : 58 – 66
- Dubuc PU, Carlisle HJ. Food restriction normalizes somatic growth and diabetes in adrenalectomized ob/ob mice. AmJ Physiol 1988; 255: R787). Ratones Ovariectomizadas mostraron un aumento en el consumo de alimentos, disminución de las actividades de funcionamiento de la rueda, y el aumento de la masa grasa, la cual se puede invertir con reemplazo de estrógenos
- Laudenslager ML, Wilkinson CW, Carlisle HJ, Hammel HT. Energy balance in ovariectomized rats with and without estrogen replacement. Am J Physiol 1980; 238: R400-R5
- Faulds MH, Zhao C, Dahlman-Wright K, Gustafsson JÅ. The diversity of sex steroid action: regulation of metabolism by estrogen signaling.J Endocrinol. 2012 Jan;212(1):3-12
- Matthews J & Gustafsson JA 2003 Estrogen signaling: a subtle balance between ER alpha and ER beta. Molecular Interventions 3 281–292
- Simerly RB, Chang C, Muramatsu M, Swanson LW. Distribution of androgen and estrogen receptor mRNA-containing cells in the rat brain: an in situ hybridization study. J Comp Neurol. 1990 Apr 1;294(1):76-95.
- Simonian SX, Herbison AE. Differential expression of estrogen receptor and neuropeptide Y by brainstem A1 and A2 noradrenaline neurons. Neuroscience. 1997 Jan;76(2):517-29
- Musatov S, Chen W, Pfaff DW, Mobbs CV, Yang XJ, Clegg DJ, Kaplitt MG, Ogawa S.Proc Natl Acad Sci U S A. 2007 Feb 13; 104(7):2501-6
- Misso M, Murata Y, Boon W, Jones M, Britt K, S impson E.Cellular and molecular characterization of the adipose phenotype of the aromatase-deficient mouse. Endocrinology 2003 ;144 : 1474 – 80
- Okura T, Koda M, Ando F, Niino N, Ohta S & Shimokata H 2003 Association of polymorphisms in the estrogen receptor alpha gene with body fat distribution. Int J Obes Relat Metab Disord. 2003 Sep;27(9):1020-7
- Chen SJ, Li H, Durand J, Oparil S & Chen YF 1996 Estrogen reduces myointimal proliferation after balloon injury of rat carotid artery. Circulation 93 577–584.
- Bakir S, Mori T, Durand J, Chen YF, Thompson JA & Oparil S 2000 Estrogen-induced vasoprotection is estrogen receptor dependent: evidence from the balloon-injured rat carotid artery model. Circulation 101 2342–2344
- Arenas IA, Xu Y & Davidge ST 2006 Age-associated impairment in vaso relaxation to fluid shear stress in the female vasculature is improved by TNF-alpha antagonism. American Journal of Physiology. Heart and Circulatory Physiology 290 H1259–H1263
- Macciò A, Madeddu C. Obesity, inflammation, and postmenopausal breast cancer: therapeutic implications. Scientific World Journal. 2011;11:2020-36
- Suzuki R, Saji S, Toi M. Impact of body mass index on breast cancer in accordance with the life-stage of women. Front Oncol. 2012;2:123
- Ostrowska Z, Kos-Kudła B, Marek B, Kajdaniuk D, Wołkowska-Pokrywa K. Circadian concentrations of free testosterone, selected markers of bone metabolism, osteoprotegerin and its ligand sRANKL in obese postmenopausal women. Postepy Hig Med Dosw (Online). 2011 Oct 11;65: 658-67

