Más difícil todavía: tratar una glomerulonefritis rápidamente progresiva grave en el seno de una neumonía por COVID-19
Presentamos el caso de un varón afecto por neumonía SARS-CoV-2 grave, que a la vez comienza con una glomerulonefritis rápidamente progresiva p-ANCA positiva. Se comentan las distintas posibilidades terapéuticas haciendo hincapié en la idoneidad de su administración según el momento evolutivo de la infección.
Palabras claves: Glomerulonefritis rápidamente progresiva con semilunas, Vasculitis asociada a ANCA, Aortitis, Infección por SARS-COV2.
We present the case of a male patient with severe SARS-CoV-2 pneumonia, with simultaneous onset of p-ANCA positive rapidly progressive glomerulonephritis. We discuss the different therapeutic possibilities, emphasising the appropriateness of their administration according to the time in the course of the infection.
Key words: Rapidly progressive crescentic glomerulonephritis, ANCA-Associates vasculitis, Aortitis, SARS-COV2 infection.
La actual pandemia del SARS-CoV-2 puede provocar daño por sí misma, e indirectamente al alterar los procedimientos y tratamientos que el paciente deba recibir por otras enfermedades. Comunicamos un caso complejo, de gran actualidad en el momento de urgencia sanitaria que vivimos y que afecta a un varón que ingresa en insuficiencia respiratoria por una neumonía por SARS-CoV-2 grave y que paralelamente desarrolla un fracaso renal agudo por glomerulonefritis rápidamente progresiva ANCA positiva. Se discuten las posibilidades terapéuticas en el actual contexto epidemiológico.
Varón de 60 años de origen ecuatoriano que ingresa en agosto 2020 por disnea de unos días de evolución, sin ningún otro síntoma referido. A su llegada se muestra normotenso y afebril con saturación basal de oxígeno mayor del 94%, pero taquipneico a 16 respiraciones por minuto. Se realiza RT-PCR frente al SARS-CoV-2 en exudado faríngeo con resultado positivo. En el estudio de laboratorio se identifican parámetros habituales de infección COVID, siendo llamativa la afectación renal: Creatinina en plasma 3,94mg/dl, FGe (CKD-EPI): 16, microhematuria e indicios de proteínas (tabla 1). Radiografía de tórax con neumonía bilateral intersticial (imagen 1). El paciente trabajaba como pintor en la construcción, no tenía hábitos tóxicos ni contacto con animales, y era hipertenso de larga duración.
| Días | Hb | Nf/Lf | Cr/FGe | PCR | GPT/GOT | DD | Ferritina | IL-6 | pANCA (anti-MPO) | Orina | Otros |
|---|---|---|---|---|---|---|---|---|---|---|---|
| −6 meses | 1,3/64 | 100,4 | CAC>30Hmt 200 (10-20pc) | ||||||||
| 1 | 9,6 | 5,25 | 3,94/ | 59 | 59/40 | 164 | 114,23 | Hmt CPC 418,8 | |||
| 2 | 9,3 | 13,5 | 4,59/ | 74 | 74/41 | 160 | PCR Cov (+) | ||||
| 4 | 8,1 | 6,25 | 5,26/ | 70 | 70/43 | 134 | 41 | ||||
| 6 | 11,4 | 11,5 | 5,58/ | 124 | 124/123 | 140 | Bolos MPR | ||||
| 7 | 11,0 | 13 | 5,21/ | 433 | 433/334 | 150 | PCR Cov (+) | ||||
| 9 | 10,8 | 12,3 | 5,45/ | 647 | 647/324 | 170 | 1.867 | 55 | Prd 1mg/kg/día | ||
| 10 | 10,8 | 20,2 | 121 | 306/76 | 186 | BxR | |||||
| 12 | 9,1 | 17,25 | 3,8/ | 47 | 47/27 | 182 | 2.955 | 785 | |||
| 16 | 9,8 | 6 | 3,49/ | 34/36 | 385 | IgIV/5 días | |||||
| 19 | 9,3 | 7,7 | 2,93/ | 92 | 92/37 | 234 | TCZ/2 días | ||||
| 21 | 10,8 | 4 | 2,59/ | 107 | 107/69 | 400 | Hmt 200 | PCR Cov (+)IgG (+) | |||
| 23 | 8,8 | 5,75 | 2,78/ | 180 | 180/68 | 568 | RTXMB | ||||
| 24 | 11,2 | 7,6 | 2,8/ | 90 | 90/45 | 410 | |||||
| 28 | 11,3 | 8,8 | 3,01/ | 49 | 49/24 | Hmt 80 | IgG (+) | ||||
| 29 | 11,9 | 9,25 | 3,0/ | 37 | 37/16 | 1.120 | 130 | 17,88 | CCr 18 PRto 0,3g/24h PCR (+) | ||
| 35 | 11,3 | 8.7 | 3,0/ | 35 | 335/16 | Hmt 80 | PCR (−) | ||||
| 37 | 12,0 | 17,3 | 2,85/ | 35 | 35/15 | ||||||
| 41 | 12,0 | 11 | 2,92 | 88 | 88/29 | Hmt 25 (aislados) CPC 310,59 | PCR (−) | ||||
| 48 | 12,1 | 13,4 | 2,5 | 92 | 92/23 | 570 |
CAC: cociente albúmina/creatinina; CCr: aclaramiento de creatinina en ml/min; CPC: cociente proteína creatinina en mg/ Cr; Cr/FGe: creatinina en sangre en mg/dl y filtrado glomerular estimado CDK-EPI; DD: dímero D (turbidimétrico) en μg/l; Ferritina en ng/ml; GPT/GOT: transaminasas en U/l; Hb: hemoglobina en g/dl; HMT: hematíes en orina elemental; IgG: inmunoglobulina G frente al SARS-CoV-2; IgIV: inmunoglobulinas intravenosas; IL-6: interleucina 6 en pgr/mL; MPR: metilprednisolona a dosis de 250mg/d/3 días; Nf/Lf: ratio neutrófilos/linfocitos; pANCA: anticuerpos anticitoplasma, patrón mieloperoxidasa (MPO) en U/l; PCR: proteína C reactiva en mg/l; PCR CoV: RT-PCR frente al SARS-CoV-2; PRTo: proteinuria en orina de 24h en g/día; RTX: rituximab; TCZ: tocilizumab.
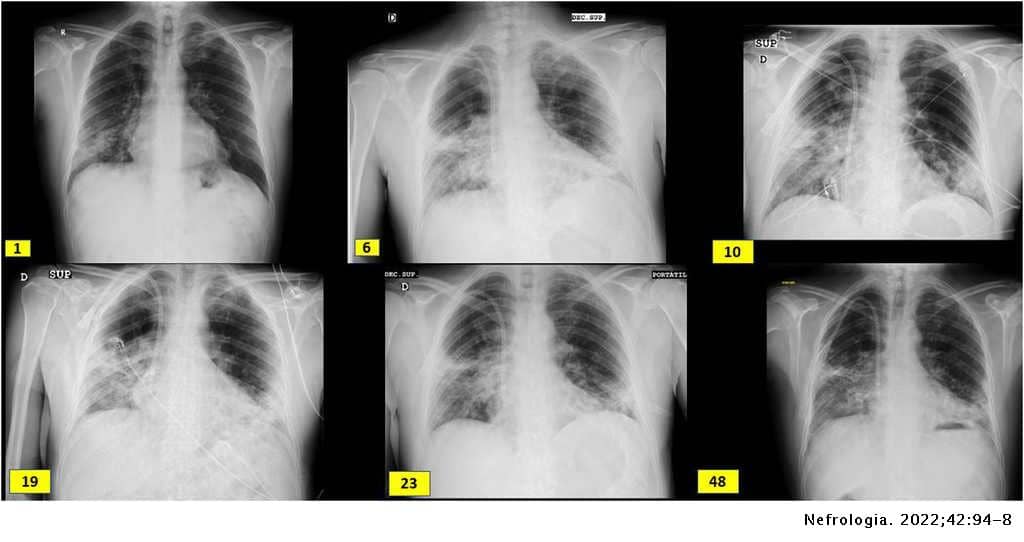
Siete años antes fue estudiado en otro centro por disnea identificándose infiltrados pulmonares múltiples y tromboembolismo pulmonar. Estudio de trombofilia negativo. Mantuvo anticoagulación oral con acenocumarol durante 6 meses.
Tres años antes estudiado, de nuevo por disnea se identificó mediante gammagrafía de ventilación-perfusión, múltiples defectos de repleción compatibles con tromboembolismos pulmonares múltiples, y se reintrodujo la anticoagulación oral.
Siete meses antes, de nuevo acude a medio hospitalario al presentar tos de varios meses de evolución con expectoración purulenta, hemoptisis autolimitada y dolor costal. Se objetivó mediante radiografía de tórax y tomografía computarizada de tórax opacidades consolidativas múltiples en LSI, LM y segmento superior del LID con nódulos inflamatorios peri broncovasculares bilaterales, uno de ellos cavitado en vértice izquierdo. Con sospecha de tuberculosis posprimaria activa fue dado de alta pendiente de exploraciones complementarias que no acudió a realizarse.
Cinco meses antes acude por primera vez a nuestro centro por presentar dolor torácico con disnea. Se identificaron signos de enfermedad pulmonar intersticial difusa, junto con nuevos infartos pulmonares. El paciente presentaba además, síndrome antifosfolípido, livedo reticularis y positividad de p-ANCA (anti-MPO) y de anticuerpos anticentrómero. Parestesias de miembros inferiores, derrame pericárdico y engrosamiento mural de aorta y troncos supraaórticos (aortitis) que se filia como vasculitis del cayado aórtico y tronco supraaórtico. La TC/PET sin signos de actividad. En ese momento ya se detecta leve afectación renal.
Se objetivan también, estenosis de arteria pulmonar e infiltrados pulmonares bilaterales de nuevo origen además del cavitado ya conocido previamente. Es dado de alta en tratamiento con colchicina, isoniazida, rifampicina pirazinamida y etambutol, que mantiene durante 3 meses, hasta recibir resultados negativos de BAAR, PCR para Mycobacterium tuberculosis e IGRA (QuantiFERON-TB Gold In-Tube®).
A su ingreso, inicia tratamiento con levofloxacino, anticoagulación profiláctica con HBPM y soporte respiratorio. Evoluciona a mayor insuficiencia renal y respiratoria. Se realiza biopsia renal a los 10 días de ingreso, con juicio clínico de glomerulonefritis proliferativa extracapilar de tipo mixto pauciinmune asociada a ANCA con cambios crónicos moderados (imagen 2).
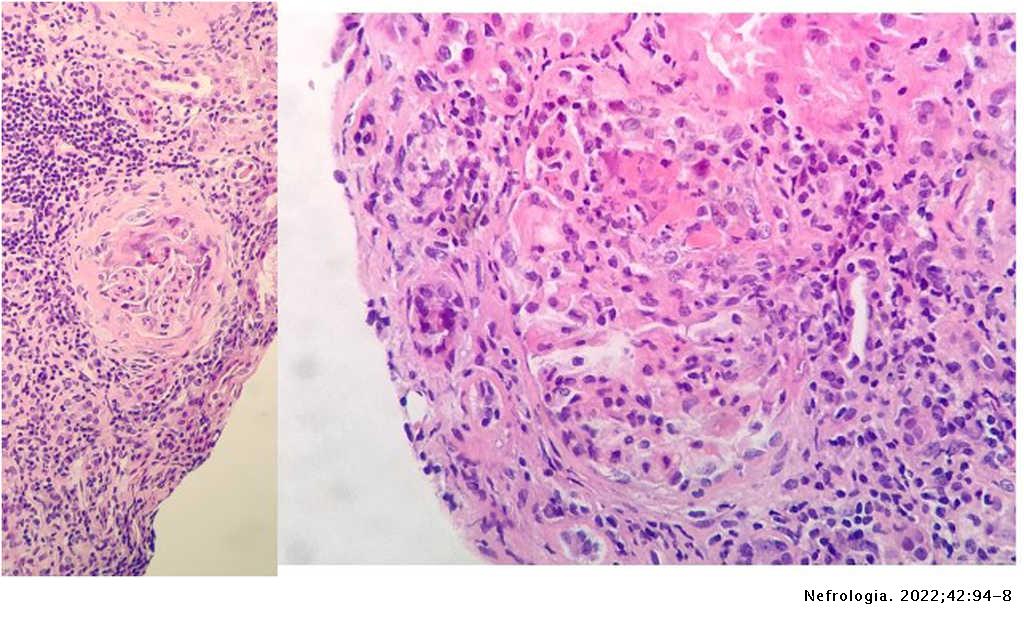
Paralelamente desarrolla hepatopatía parenquimatosa multifactorial (quinolona, hepatotoxicidad vírica y vasculitis hepática) por lo que se sustituye levofloxacino por ceftriaxona. El día 11 sufre anemización sin datos de sangrado renal posbiopsia en la ecografía que precisa hemotransfusión y hemoptisis autolimitada con fibrobroncoscopia sin hallazgos por lo que se administran 3 dosis de 500mg de metilprednisolona. Evoluciona mal, con progresión radiológica de los infiltrados, mayor insuficiencia respiratoria y renal, por lo que el día 16 iniciamos inmunoglobulinas IV a dosis de 0,2mg/kg/día durante 5 días y el día 19, tras recuperar función hepática, tocilizumab, 2 dosis, 600mg el primer día y 400mg el segundo día. Ingresa en la UCI y se trata mediante hemodiafiltración intravenosa continua (HDFVVC) (3 sesiones) y tratamiento respiratorio de soporte con VMNI a alto flujo. De forma lenta mejora renalmente, recupera filtrado glomerular y se estabiliza respiratoriamente con menor débito de oxígeno. Tras comprobar el día 21 serología IgG de COVID positiva, se programa tratamiento con rituximab, 4 dosis de 375mg/m2/semana IV. Se plantea complementar el tratamiento con nueva tanda de inmunoglobulinas, lo que no se lleva a cabo por mantener niveles adecuados en plasma. Estabiliza su función renal con FG 20-30m/min/1,73m2, pero los infiltrados respiratorios y su dependencia ventilatoria no mejoran en las 3 semanas siguientes pese a fisioterapia y soporte adecuado. Por esta tórpida evolución respiratoria se repite la fibrobroncoscopia sin hallazgos relevantes. Finalmente, puede ser dado de alta a los 50 días de ingreso con oxígeno crónico domiciliario y un FGe 27ml/min.
Este caso ilustra la dificultad que las infecciones por COVID-19 suponen en los pacientes con vasculitis activas. El paciente pasó por un periplo de ingresos y estudios previos sin finalizar e incomparecencias repetidas en parte justificadas por la inestabilidad de la situación de urgencia sanitaria en la que nos desenvolvemos. Inicialmente se sospechó enfermedad pulmonar intersticial difusa (EPID), después tuberculosis y finalmente vasculitis de gran vaso pese a disponer de una determinación de p-ANCA positiva. Pierde el seguimiento y en el momento del ingreso encontramos un fracaso renal agudo grave de data incierta en el contexto de infección COVID-19 positiva con neumonía bilateral. Además, desarrolla hepatopatía aguda que contraindica el uso de tocilizumab y la propia naturaleza de la infección vírica contraindica el uso de ciclofosfamida y rituximab en un momento de infección por SARS-COVID-19 en fase 1.
Por todo ello decidimos iniciar un tratamiento secuencial que contempló en un primer tiempo la corticoterapia, complementada con inmunoglobulinas IV y en un segundo tiempo el tocilizumab, que nos pareció el fármaco más adecuado por conjugar su efecto positivo sobre la tormenta de citocinas desarrolladas en el SARS-CoV-19 y su eficacia comprobada en vasculitis ANCA positivo1,2. Una vez que se produjo la seroconversión, iniciamos rituximab a dosis plena con buena evolución global.
La literatura es parca sobre la actitud a seguir en casos similares. La aortitis en casos de vasculitis p-ANCA está descrita suficientemente3-5. No es una superposición de vasculitis de gran y pequeño vaso, sino una parte de su espectro de manifestaciones clínicas que puede aparecer antes o a la vez que la vasculitis de pequeño vaso típica. Se produce una estenosis de los vasa vasorum debido a hiperplasia de la íntima disminuye el número de fibras elásticas en la media y evoluciona hacia estenosis como efecto tardío. Se han referido casos junto con enfermedades de Wegener y poliangiítis microscópica pero no con granulomatosis eosinofílica con poliangiítis. Chirinos et al.6 recogen los 13 casos publicados hasta el 2002 de afectación de gran vaso (aortitis) en vasculitis ANCA (+), con un rango de edad entre 27-71 años, edad media 44,7 años, ratio V/M: 1,1. Un 76% cursaron con síntomas constitucionales, el 38% artralgias y pérdida de peso, el 46% afectación de la vía aérea superior, el 53% HTA, el 53,8% proteinuria en rango de 1,8-4,5g/d, el 76,9% hematuria, 8 biopsiados de los que 7 tenían datos de GN pauciinmune y 5 proliferación extracapilar, el 46% púrpura, el 30% afectación ocular (conjuntivitis, escleroqueratitis necrosante con úlceras corneales y espiescleritis) y el 23% clínica digestiva (dispepsia y dolor abdominal).
El uso de tocilizumab en vasculitis p-ANCA está avalado por diversas publicaciones previas a la era COVID1,2. Takenaka et al.1 describen a una mujer japonesa de 47 años con vasculitis p-ANCA, paquimeningitis hipertrófica, hemorragia alveolar y aortitis que no respondió a prednisolona y ciclofosfamida, pero sí a tocilizumab a dosis de 400mg/mes que se mantuvo durante un año. No es el único caso7–11. Sakai et al. describen 2 casos más y repasan la literatura encontrando 17 casos hasta 2017, tratados mediante tocilizumab de los que en 15 (88,2%) se consiguió remisión completa con la asociación de tocilizumab 8mg/kg/mes durante un año junto con prednisolona 1mg/kg/día/durante 2 semanas con descenso progresivo hasta suspender en 24 semanas.
No hay claras recomendaciones sobre cuál es la mejor estrategia ante un paciente con vasculitis e infección activa por COVID-19. Las guías inglesas1 dejan entrever que rituximab es preferible a ciclofosfamida pero sin una justificación de peso. En algunos casos descritos, el tratamiento inmunosupresor no aumentó aparentemente la gravedad de la COVID-1912–14. Lo explican por la acción deplecionante de rituximab sobre las células B periféricas, incluyendo las B de memoria y la modulación de la respuesta citotóxica dependiente de anticuerpos, la dependiente de complemento y la apoptosis, pero no las células B precursoras que no expresan CD20. Sí afirman que puede minimizar la respuesta inmunógena tras vacunación. Por el contrario, otros artículos15–17 sugieren que puede inducir complicaciones graves o alargar la viremia. Para evitar esto se sugiere complementar con plasma fresco el tratamiento en pacientes que hayan recibido fármacos deplecionantes de células B18,19.
En el paciente que presentamos la pauta secuencial utilizada consiguió controlar la vasculitis, no sin riesgos. El proceso de curación del COVID-19 se enlenteció y la RT-PCR se mantuvo positiva durante 35 días, lo que demuestra la complejidad de estos casos y la dificultad que plantean a la hora de priorizar estrategias terapéuticas.
Este trabajo no ha recibido ningún tipo de financiación.
Los autores declaran no tener ningún conflicto de intereses.
Dr. Eduardo Gutiérrez Martínez del Sv° de nefrología del Hospital 12 Octubre por sus buenos consejos.
https://doi.org/10.1016/j.nefro.2020.12.006
0211-6995 / © 2021 Sociedad Española de Nefrología.
Publicado por Elsevier Espana, S.L.U.
Este es un artículo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
Autores
Juan A. Martín Navarro
Juan A. Martín Navarro (a), Melissa Cintra Cabrera (a), Fabio Lucca Proccacini (a), Jorge Muñoz Rodríguez (b), David Roldán Cortés (b), Rafael Lucena Valverde (a), Mayra Ortega Díaz (a), Marta Puerta Carretero (a), Juana Gil Herrera (c), Maria Teresa Jaldo Rodríguez (a), Marta Albalate Ramón (a), Elena Corchete Prats (a), Laura Medina Zahonero (a), Patricia de Sequera Ortiz (a), Roberto Alcázar Arroyo(a)
(a) Servicio de Nefrología, Hospital Universitario Infanta Leonor, Madrid, España
(b) Servicio de Anatomía Patológica, Hospital Universitario Infanta Leonor, Madrid, España
(c) Servicio de Inmunología, Hospital Gregorio Marañón, Madrid, España
-
Este autor no ha escrito más artículos.
Sociedad Española de Nefrología
https://www.revistanefrologia.com/
0211-6995 / © 2021 Sociedad Espanola de Nefrologia.
Publicado por Elsevier Espana, S.L.U.
Este es un artıculo Open Access bajo la licencia CC BY-NC-ND
(http://creativecommons.org/licenses/by-nc-nd/4.0/).
-
Sociedad Española de Nefrología#molongui-disabled-link
-
Sociedad Española de Nefrología#molongui-disabled-link
-
Sociedad Española de Nefrología#molongui-disabled-link

