Accidente ofídico en falcón, estudio preliminar de la eficacia y seguridad del antiveneno polivalente IgY, producido regionalmente
RESUMEN
Objetivos: Evaluar la eficacia y la seguridad clínica de un antiveneno polivalente (antibotrópico y anticrotálico) elaborado a partir de yemas de huevos de gallinas hiperinmunizadas (IgY), producido regionalmente por el laboratorio Labfarsca-Universidad Nacional Experimental Francisco de Miranda.
Métodos: se realizó durante 4 meses un ensayo clínico-terapéutico de los envenenamientos que llegaron al hospital universitario Dr. Alfredo Van Greiken de la ciudad de Coro en el estado Falcon.
Resultados: Treinta (30) pacientes fueron envenenados por serpientes Bothrops spp, género responsable de más del 80% de los accidentes ofídicos del estado Falcón y un (1) paciente por cascabel Crotalus durissus c; y el tratamiento administrado a las dosis recomendadas fue de 1 frasco para los casos leves, 2 moderados y 3 para los graves. La severidad del envenenamiento fue clasificada de acuerdo al protocolo del hospital y reevaluados a las 12 horas, el grado final de envenenamiento fue leve 15 (48,4%) pacientes, moderado 10 (32,2%) y grave 6 pacientes (19,3%). La resolución clínica del envenenamiento fue satisfactoria en 29 (93,5%) de los pacientes tratados. Ninguno presento reacciones adversas de tipo alérgica a la inmunoterapia. Catorce (14) pacientes (45,1%) fueron atendidos inicialmente por curanderos en sus comunidades de los cuales se complicó un (1) paciente que fue amputado por uso prolongado del torniquete y hubo una (1) muerte por tratamiento tardío.
Conclusión: a las dosis utilizadas en este estudio del antiveneno a base de IgY Labfarsca-Universidad Nacional Experimental Francisco de Miranda, fue eficaz y seguro para el tratamiento del envenenamiento botrópico en Falcón. No hubo una casuística significativa para demostrar la efectividad del tratamiento en envenenamientos crotalico.
PALABRAS CLAVE: Bothrops colombiensis, Crotalus durissus c., envenenamiento ofídico, IgY, inmunoterapia, Venezuela.
SUMMARY
OPHIDIC ACCIDENT IN FALCÓN, VENEZUELA; A PRELIMINARY STUDY OF THE EFFICACY AND SAFETY OF A POLYVALENT ANTIVENOM IG Y, REGIONALLY PRODUCED.
Results: Thirty (30) patients were envenomated by Bothrops colombiensis snakes, responsible for more than 80% of ophidian accidents in Falcón state, and one (1) patient by rattlesnake Crotalus durissus; The severity of the envenomation was classified according to the hospital protocol and reevaluated after 12 hours, and the treatment was administered at the recommended doses of 1 vial for mild cases, 2 for moderate and 3 for severe cases. The final degree of envenomation was mild in 15 patients (48.4%), moderate in 10 patients (32.2%) and severe in 6 patients (19.3%). The clinical resolution of the poisoning was successful in 29 (93.5%) of the patients treated. No patient presented allergic adverse reactions to immunotherapy. Fourteen (14) patients (45,1%) were initially attended by healers in their communities, with one (1) patient complicated that was amputated due to prolonged use of the tourniquet, and there was one (1) death due to delayed treatment.
Conclusion: at the doses used in this study, the antivenom Labfarsca- University Francisco de Miranda based on IgY, was effective and safe for the treatment of bothropic envenomation in Falcón. There was no significant clinical data to demonstrate the effectiveness of the treatment in crotalid poisoning.
KEYWORDS: Bothrops colombiensis, Crotalus durissus c., snake envenomation, IgY, immunotherapy, Venezuela.
1. INTRODUCCIÓN
El accidente ofídico es un serio problema de salud pública a nivel global; en Venezuela, considerado el duodécimo país con mayor mega diversidad del mundo (1), a pesar de existir un subregistro, se declaran entre 5000 y 7000 casos anuales, de acuerdo con los datos de la División de Epidemiología del Ministerio del Poder Popular para la Salud, con un promedio de 21,24 accidentes por cada 100 mil habitantes (2). La mayor incidencia se presenta las regiones centro-occidental (Falcón, Yaracuy y Lara), en los trimestres de febrero-abril y junio-agosto, con una mortalidad del 2% (3).
En el territorio venezolano, de 80 a 90% de los accidentes ofídicos son del tipo botrópico (5, 2, 6) repartidas en 3 géneros: Bothrops, Botriechis y Porthidium. Son los responsables del mayor número de muertes por envenenamientos debido a la gran agresividad, características de los venenos y vasta distribución geográfica de estos ofidios. Sin embargo, solo seis especies son responsables de la casi totalidad de estos envenenamientos y muertes (4). Bothrops colombiensis es la serpiente de mayor incidencia en el ofidismo del estado Falcón (5, 2, 6, 7, 8, 4). La incidencia del accidente crotálico es alrededor del 10%, tiene su mayor magnitud en regiones áridas y semiáridas del país. Los accidentes lachésicos y micrúricos son mucho menos frecuentes, aunque muy severos cuando ocurren.
Los venenos botrópicos inducen intensos efectos locales (edema, hemorragia, formación de flictenas o bulas, dermonecrosis y mionecrosis) y graves efectos sistémicos que ponen en peligro la vida (desfibrinación, trombocitopenia, hemorragias en otros órganos,diversidad del mundo (1), a pesar de existir un subregistro, se declaran entre 5000 y 7000 casos anuales, de acuerdo con los datos de la División de Epidemiología del Ministerio del Poder Popular para la Salud, con un promedio de 21,24 accidentes por cada 100 mil habitantes (2). La mayor incidencia se presenta las regiones centro-occidental (Falcón, Yaracuy y Lara), en los trimestres de febrero-abril y junio-agosto, con una mortalidad del 2% (3). En el territorio venezolano, de 80 a 90% de los accidentes ofídicos son del tipo botrópico (5, 2, 6) repartidas en 3 géneros: Bothrops, Botriechis y Porthidium. Son los responsables del mayor número de muertes por envenenamientos debido a la gran agresividad, características de los venenos y vasta distribución geográfica de estos ofidios. Sin embargo, solo seis especies son responsables de la casi totalidad de estos envenenamientos y muertes (4). Bothrops colombiensis es la serpiente de mayor incidencia en el ofidismo del estado Falcón (5, 2, 6, 7, 8, 4). La incidencia del accidente crotálico es alrededor del 10%, tiene su mayor magnitud en regiones áridas y semiáridas del país. Los accidentes lachésicos y micrúricos son mucho menos frecuentes, aunque muy severos cuando ocurren. Los venenos botrópicos inducen intensos efectos locales (edema, hemorragia, formación de flictenas o bulas, dermonecrosis y mionecrosis) y graves efectos sistémicos que ponen en peligro la vida (desfibrinación, trombocitopenia, hemorragias en otros órganos, nefrotoxicidad) (12, 13, 14). Por su parte, el veneno crotálico es fundamentalmente neurotóxico y miotóxico, cuyos efectos sistémicos pueden desencadenar paro cardio-respiratorio o insuficiencia renal aguda inducida por la mioglobina liberada en la rabdomiolisis. Las serpientes de cascabel del noroccidente del estado Falcón poseen además propiedades hemorrágicas (15).
La terapia antivenenosa establecida está basada en IgG de origen equino; a pesar de tener más de 100 años desde su descubrimiento en 1906 por Calmet y Vital Brazil (16), no ha podido resolver todos los problemas originados por los venenos de serpientes, especialmente los efectos locales que son de rápida instalación (menos de 2 horas) y causan secuelas por necrosis, con pérdida de masa muscular, síndrome compartimental y amputaciones (botrópicos). Adicionalmente, los antivenenos con base en IgG de equinos generalmente inducen reacciones anafilácticas tempranas y tardías relacionadas con las dosis aplicadas en los pacientes, como la enfermedad del suero, que produce vasculitis, glomerulonefritis y artritis, o por sensibilización previa a componentes del antiveneno que pueden desencadenar urticaria, edema de glotis y broncoespasmos, entre otros síntomas (17, 18). Se informa alrededor del 11% de tales reacciones en los antivenenos faboterápicos (tercera generación [F(ab ́) 2] y cuarta generación (Fab)) y hasta un 20% en los de IgG total (19, 20, 21, 22), aunque en Colombia se registran reacciones hasta en un 90% de las personas cuando fueron tratadas con IgG total (23).
Por otro lado, la producción de antíveneno a partir de suero de equinos es cada vez más un proceso de alto costo que conduce a una continua reducción global de sus fabricantes (24, 25, 26). Dado que el ofidismo sigue siendo un problema de salud mundial y ha sido incluido por la Organización Mundial de la Salud en la Categoría A de “Enfermedades Tropicales Desatendidas”, se requiere de grandes esfuerzos para garantizar la disponibilidad de estos medicamentos biológicos complejos en el sistema de atención primaria de salud de todos los países, incluida la estrategia de usar inmunoglobulinas de fuentes alternativas (26, 28).
Las IgY son la principal molécula de anticuerpos producidas por las aves; son transferidas desde el plasma sanguíneo a la yema de los huevos a través del oviducto, lo cual permite la purificación de estos anticuerpos a partir de yemas de huevos con un alto rendimiento, éticamente viable y de modo relativamente sencillo y económico (29).
La distancia evolutiva entre IgY y proteínas de mamíferos favorece sus aplicaciones en investigación, diagnóstico y terapéutica; IgY (30). Las IgY purificadas no contienen ovoalbúmina, por lo cual puede utilizarse inclusive en pacientes con alergias al huevo; al no activar el sistema de complemento mamífero el riesgo de inflamación es mínimo. Diversos autores han informado la capacidad neutralizante de toxinas de ofidios por antivenenos elaborados con tecnología IgY en ensayos animal (31, 29). En Venezuela hay un solo productor de antivenenos, elaborados con IgG de origen equino (Biotecfar®-Universidad Central de Venezuela), pero hay un mercado insatisfecho por diferentes razones técnicas. Debido a una contingencia caracterizada por ausencia de antivenenos en el estado Falcón entre los meses septiembre-diciembre 2021, se recurrió a un antiveneno elaborado con la tecnología IgY, elaborado por el laboratorio Labfarsca-Universidad Nacional Experimental Francisco de Miranda (UNEFM), para aplicar terapia a pacientes envenenados por serpientes Bothrops spp y Crotalus durissus c., provenientes de distintas zonas rurales del estado, atendidos en el Hospital Universitario de Coro “Alfredo Van Griecken, Falcón-Venezuela (HUAVG).
MATERIALES Y MÉTODOS
Elaboración y ensayos de control de calidad del antiveneno.
El antiveneno fue elaborado mediante la tecnología IgY luego de purificar anticuerpos polivalentes (antibotrópicos-anticrotálicos) mediante el protocolo modificado de cloroformo/polietilenglicol (33), a partir de huevos de gallinas hiperinmunizadas con una mezcla de venenos de Bothrops colombiensis y Crotalus durissus cumanensis (mezcla de especímenes juveniles y adultos).
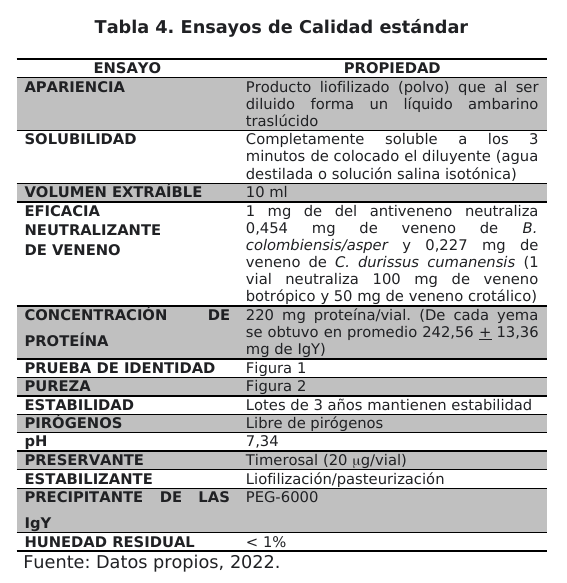
El producto final se analizó para determinar concentración de proteínas, apariencia, solubilidad, volumen extraíble, eficacia neutralizante del veneno (actividad hemorrágica, necrotizante, miotóxica y desfibrinogenante), pureza, estabilidad, concentración de preservantes, prueba de esterilidad y prueba de pirógenos, de acuerdo a la metodología recomendada por la OMS en su guía para el control y producción de antivenenos (capítulo 17 sobre control de calidad de antivenenos) (26)(43).
Pacientes y métodos
Pacientes
A su ingreso al Hospital Universitario Alfredo Van Greikin, a cada
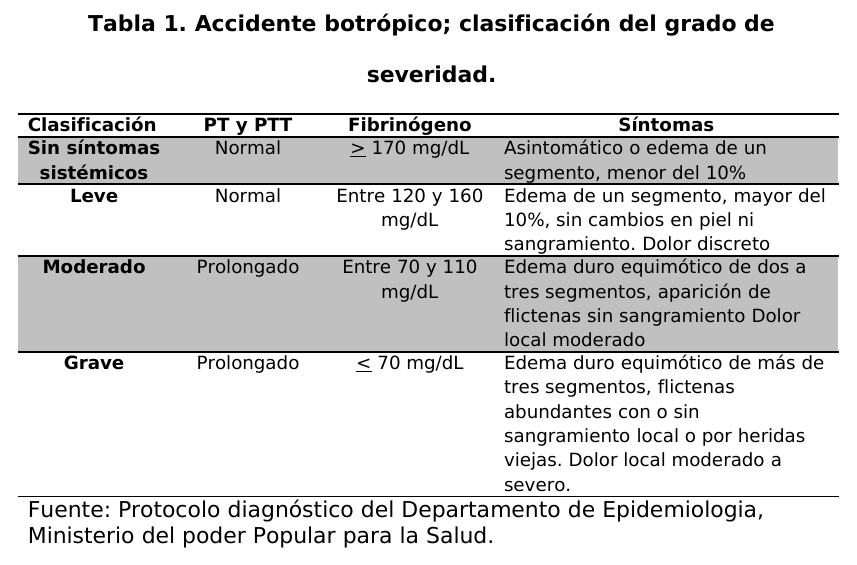
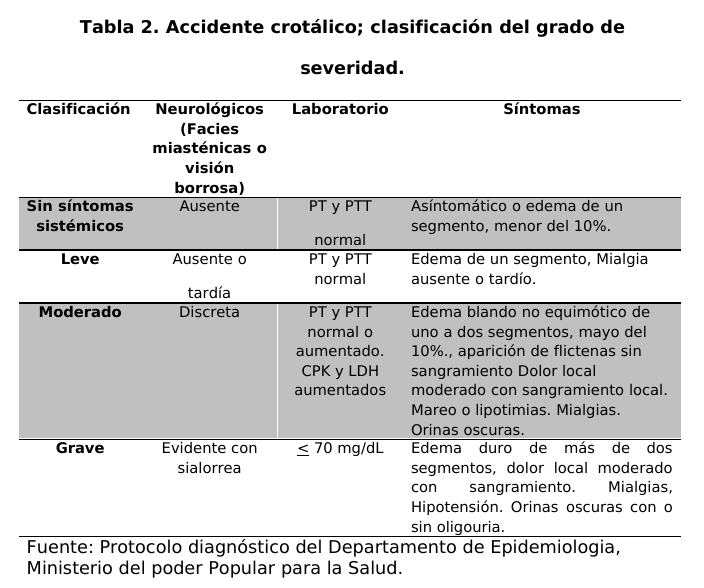
paciente se le realizó la evaluación clínica para hacer un diagnóstico diferencial de acuerdo a los signos y síntomas que presento el paciente para determinar la naturaleza ofídica del envenenamiento y clasificar el grado de severidad (tablas 1 y 2).
Administración del antiveneno
Previo a la colocación del antiveneno, se obtuvo el consentimiento informado de todos los pacientes o de sus familiares donde fue explicado por el médico tratante la naturaleza experimental del tratamiento.
Se administro la totalidad de dosis del antiveneno de acuerdo a la clasificación de severidad por infusión IV diluido en 500 ml de solución fisiológica 0.9 normal (niños a razón de 20 ml/Kg. de peso corporal), el cual se pasó en un tiempo de 1 hora. (Tabla 3). En los niños se usó las mismas cantidades de antiveneno que en el adulto. No se colocó medicación antialérgica previa al tratamiento (antihistamínicos o esteroides preventivos). En consecuencia, se vigiló estrictamente a todos los pacientes durante 24 horas para evaluar potencialmente reacción contra la IgY durante la inmunoterapia. Se consideraron como criterios de eficacia de la dosis inicial de antiveneno el cese de las hemorragias local y sistémica (diferentes de la hematuria) en las primeras 12 horas de tratamiento y la normalización de la coagulación sanguínea (pruebas de coagulación y fibrinógeno) durante las primeras 24 horas del tratamiento antiveneno. Si no se lograban esos criterios, se reclasificaba al grado de severidad inmediatamente superior y se colocaba las dosis de antiveneno adicional.
Se elaboro una ficha epidemiológica de cada caso, por ser en Venezuela el envenenamiento ofídico una enfermedad de denuncia obligatoria. En el formulario se registraron los siguientes datos: edad, sitio de la mordedura y tiempo transcurrido entre ésta, el ingreso y el comienzo de la terapia antiveneno; atención por la medicina tradicional (torniquetes, bebedizos, inyecciones); tamaño y especie de la serpiente; signos de envenenamiento local y sistémico; resultados de los exámenes hematológicos, de química, clínica e imágenes diagnósticas; pruebas de coagulación y determinación de la concentración de fibrinógeno en el plasma al ingreso, 12, 24 horas post tratamiento y al egreso; dosis del antiveneno; reacciones tempranas adversas; tratamientos complementarios (antibióticos, cirugías, etc.); complicaciones y evolución final.
Además, se realizó seguimiento por vía telefónica de la evolución posterior a su egreso con el servicio médico local o directamente con el paciente o sus familiares (en sitios donde no hay servicio médico) para determinar la evolución y las secuelas. Se programaron citas de revisión después del alta.
RESULTADOS
El control de calidad del producto final para el aseguramiento de la calidad del antiveneno Labfarsca-UNEFM se resume en la tabla 4. Los resultados obtenidos indican que el antiveneno cumple con las especificaciones aprobadas por las normas que como fabricante plantea Labfarsca-UNEFM y establecidas por la OMS para antivenenos de uso humano y forman parte del registro de información para cada lote. Estos resultados indican que el antiveneno cumple con los criterios de calidad estándar y potencia para su uso en la terapia antiofídica con criterios de eficacia e inocuidad, y representan una alternativa a la terapia con IgG.
Aspectos clínicos y epidemiológicos.
Entre septiembre y diciembre 2021, Treinta y uno (31) pacientes llenaron los criterios clínicos para su inclusión en el protocolo de tratamiento; 30 de ellos fueron envenenados por Bothrops colombiensis y uno por Crotalus durissus cumanensis. De acuerdo a la distribución etaria, seis (6) pacientes (19,3%) eran menores de 12 años, y veinticinco (25) pacientes adultos (80,6%). Todos los pacientes tuvieron más de un signo local del envenenamiento (los más frecuente fueron sangramiento por sitio de impronta de los colmillos, edema, flictenas y equimosis en el miembro afectado). Catorce (14) pacientes (45,1%) fueron atendidos inicialmente por curanderos en sus comunidades, donde recibieron remedios tradicionales. En un solo caso hubo complicaciones por necrosis local en el cual se colocó un torniquete en el miembro inferior por 3 horas.
Acudieron al hospital en las primeras dos horas posteriores al envenenamiento dos (2) pacientes (6.4%), otros veintidós (22) acudieron entre tres y seis horas, seis (6) consultaron posterior a las doce horas (19,3%) y un (1) paciente acudió después de treinta y seis horas.
Signos sistémicos de envenenamiento.
El grado final de envenenamiento fue leve quince (15) pacientes (48,4%), moderado diez (10) pacientes (32,2%) y grave seis (6) pacientes (19,3%). Presentaron algún signo de hemorragia: sangrado gingival, hematemesis, hematuria o metrorragia. Ocho (8) pacientes (25,8) fueron reclasificados y recibieron una dosis adicional de antiveneno.
Respuesta terapéutica y complicaciones.
De los 31 pacientes, veintinueve (29) pacientes (93,5%) ceso la hemorragia local y el fibrinógeno se normalizó a las 24 horas. Una paciente presento metrorragia no coincidente con periodo menstrual antes de las 12 horas, en la cual se corrigió con colocación de antiveneno adicional. Solo uno (1) falleció por coagulación intravascular diseminada a las 22 horas post ingreso (Tabla 5). Hubo dos (2) recurrencias de coagulopatía sin sangrado posterior a la restauración de la coagulación en las primeras 24 horas, por fibrinógeno normal con INR alto, que se corrigieron en ambos casos con la aplicación de crioprecipitado y plasma fresco.
En veintitrés (23) pacientes (74,2%) no progresó el edema después de aplicado el antiveneno. Solo en ocho (8) casos recibieron dosis adicionales de antiveneno por hipofibrinogenemia persistente y progresión del edema a las 12 horas. No hubo ningún paciente que presentó reacción anafiláctica tipo I o II al tratamiento durante su hospitalización.
Se evidencio por laboratorio leucocitosis con aumento de segmentados en dieciocho (18) pacientes (58%) los cuales se les colocó antibioticoterapia betalactámicos preventivo a pesar de no tener signos de celulitis o absceso. Un (1) paciente presentó complicaciones por maniobras externas tipo torniquete con síndrome compartimental por lo que requirió fasciotomía en el dorso del pie derecho y luego amputación de la pierna derecha.
DISCUSIÓN
El reporte efectuado por el Comité de Expertos de la Organización Mundial de la Salud en estandarización biológica (26), refiere a los ensayos clínicos controlados como la mejor forma de evaluar la eficacia, dosificación y seguridad de un antiveneno, dado que la mayoría de los antiveneno en uso comercial se han registrado sin estudios clínicos previos.
El uso de suero hiperinmune IgG de origen equino es el estándar mundial desde hace más de 100 años, el cual está en su cuarta generación como faboterapia F(abʹ)2)) y (F(ab). Lo cual ha abierto una nueva etapa en la terapia en accidentes ofídicos; algunos antivenenos de baja masa molecular como los fragmentos F(ab), aun cuando pueden ser más adecuados contra las neurotoxinas, su rápida eliminación del organismo ha conducido a la recurrencia de síntomas por envenenamiento en los pacientes. Sin embargo, los anticuerpos bivalentes (IgG y fragmentos F(abʹ)2) de mayor peso molecular pueden resultar eficaces para una neutralización prolongada y completa de las toxinas intravasculares (enzimas procoagulantes, fosfolipasas A2), que tienen una vida media larga en pacientes envenenados, pero estos producen más recciones anafilácticas (20, 21, 38, 48).
Las inmunoglobulinas IgY de aves como la gallina son una interesante alternativa para su uso como antiveneno ofídico; estudios han demostrado que las IgY pueden presentar títulos muy altos con gran especificidad frente al antígeno de interés (39, 40). Estas moléculas son el equivalente estructural de los fragmentos F(ab) de las IgG, se ha sugerido llamarlos IgY(∆Fc) (41, 42, 43). Cuando se emplean inmunoglobulinas de gallina IgY tampoco activan el sistema de complemento como ocurre en forma variable entre especies de mamíferos.
En la mayoría de las regiones tropicales donde las mordeduras de serpiente son una carga médica significativa, los antivenenos poliespecíficos ofrecen ventajas clínicas y su producción se debe incentivar (26). La decisión de preparar antivenenos debe ser guiada por información epidemiológica y clínica sobre las mordeduras de serpientes en la región o el país. En el diseño de la mezcla de venenos usados en la inmunización de las gallinas en el laboratorio Labfarsca-UNEFM, se tomó en cuenta la información epidemiológica del estado Falcón (9), de esta manera hemos podido minimizar la administración de viales de antiveneno durante el tratamiento para revertir la patología del veneno, lo cual a su vez disminuye el riesgo de reacciones adversas.
Los protocolos de tratamiento varían para cada país, por ello no se puede generalizar el tratamiento de accidentes ofídicos. Los más conocidos son el recomendado por la Organización Mundial de la Salud, aquel del manual de emergencias toxicológicas de Goldfrank ́s, y el método sugerido en el manual de manejo clínico de envenenamientos de Haddad and Winchester’s. Varían los criterios en la determinación de la severidad del envenenamiento, uso inicial de viales de antiveneno y la repetición de la misma durante la hospitalización (3). Dado que no hay protocolos establecidos de tratamiento del envenenamiento ofídico con antiveneno por IgY pues esta terapéutica es novedosa, nosotros hicimos un protocolo basado en las recomendaciones de la Organización Mundial de la Salud y modificado de acuerdo a las pruebas de neutralización del antiveneno Labfarsca-UNEFM frente a los venenos bothropico y crotalicos en ensayos de laboratorio.
La acción procoagulante de los venenos ofídicos (botrópico y crotálico), con hipodisfibrinogenemia (disminución de la cantidad y alteración de su función), que se presenta durante el envenenamiento, aunado al daño en la microvasculatura inducido por las hemorraginas, facilita el sangrado tanto local como en órganos distantes del sitio de la mordedura, que puede poner en peligro la vida del paciente. Por tal motivo, en diversos estudios de accidentes ocasionados por estas especies de serpientes, llevados a cabo en América y en otros continentes (44, 20, 45, 46, 47, 38, 48), se ha concluido que una de las metas del tratamiento con antivenenos es detener en las primeras 6-12 horas el sangrado local y sistémico y normalizar la coagulación sanguínea. Los resultados del presente trabajo son similares a los de estudios controlados hechos previamente en Colombia con antivenenos F(ab’)2, producidos en Brasil (Instituto Butantán), y de IgG total producidos en Costa Rica (Instituto Clodomiro Picado) y Colombia (Instituto Nacional de Salud), puesto que en nuestro ensayo casi todos los pacientes (93,5%) detuvieron los sangrados locales y sistémico en las primeras 6-12 horas, y se normalizó la coagulación en las primeras 24 horas. (Tabla 5). Estos criterios son simples y están al alcance de todos los clínicos en todos los lugares, para valorar la eficacia de un antiveneno en accidente por vipéridos.
Es bajo el número de pacientes envenenados por Bothrops spp que normalizan los factores de coagulación en 6 horas (60), pues el organismo debe pasar por un proceso de síntesis hepática y homeostasis de la fibrinolisis secundaria. Por lo tanto, sigue siendo adecuado la reevaluación de la coagulación a las 12 y 24 horas posterior a la colocación del antiveneno. En este estudio, 22 pacientes (70,9%) corrigieron los valores de coagulación a las 12 horas, 8 pacientes recibieron dosis adicionales de antiveneno que permitió la normalización a las 24 horas.
El hallazgo de la persistencia de hipoprotrombinemia leve en dos (2) casos con concentraciones normales de fibrinógeno a las 24 horas después del tratamiento ha sido descrito por otros autores (49, 50, 51) especialmente con el uso de antivenenos de baja potencia neutralizante de la fracción activadora de la protrombina, en comparación con su alta actividad frente a otros componentes del veneno. A pesar que esto es una posibilidad, creemos que estos hallazgos se deben más a factores idiosincráticos de los pacientes pues fue baja su ocurrencia, por ellos preferimos manejar los casos con terapéutica con crioprecipitado y plasma fresco para aportar y normalizar los factores de coagulación, que suministrar antiveneno adicional.
En los casos de tratamiento tardío (más de 4 horas después de ocurrido el envenenamiento) el veneno se puede difundir a un tercer espacio (depósitos tisulares y sistema linfático) y de allí hacia el torrente circulatorio, de tal manera que finalmente la concentración sérica de antiveneno es insuficiente para neutralizarlo todo, donde se observa mejoría parcial y la recurrencia de los signos de envenenamiento (hemorragia, edema, coagulopatía con hipofibrinogenemia y trombocitopenia). En el trabajo 29 pacientes (97,3%) acudieron tardíamente al hospital posterior al envenenamiento; por distancia del traslado y otros por un fenómeno cultural, donde se demora el traslado esperando el efecto de algún tratamiento folclórico (bebedizo por curandero, toma de orine de venado, rezos), 14 pacientes (45,1%) fueron atendidos inicialmente por curanderos. Un paciente acudió 36 horas posterior al envenenamiento con un desenlace fatal de coagulación intravascular diseminada. El manejo clínico de los envenenamientos ofídicos tardíos es uno de los mayores retos médicos, por la desregulación homeostática simultánea de muchos sistemas. De lo anterior permite también sugerir que las dosis adicionales estarían recomendadas en las siguientes circunstancias; si a las 12 horas persiste un sangrado (no hematuria), el fibrinógeno no se recupera en 50% de su valor normal; si a las 24 horas persiste la coagulopatía, aumenta los marcadores de destrucción tisular CK, LDH, o en casos de recurrencia de cualquiera de estas situaciones clínicas. (49, 52). También en virtud de las complicaciones en envenenamientos tardíos, sugerimos crear otra categoría en envenenamiento botrópico: Grave + donde se aplicaría una dosis extra de antiveneno en aquellos casos donde se retarde el tratamiento más de 4 horas.
A pesar de las innovaciones tecnológicas introducidas en la producción de los antivenenos faboterapicos, no se ha logrado eliminar las lesiones locales tempranas. En este estudio, dieciocho (18) pacientes (58%) presentaron leucocitosis con aumento de segmentados a pesar que ningún paciente desarrollo celulitis o abscesos. Se sabe que la IgY presenta reactividad ante bacterias como Estafilococo y Estreptococo spp, que podría explicar este fenómeno observado en nuestros pacientes, sin embargo es un campo en el cual se debe profundizar su estudio (53, 42, 40, 43, 54).
Las reacciones de hipersensibilidad tempranas y tardías con el uso de antivenenos puede tener su origen en: la IgG (total y F(ab)) por activación del complemento, a pesar de los avances de los antivenenos faboterapicos aún está presente, lo cual en algunos casos puede poner en riesgo la vida del paciente. También puede haber reacciones idiosincráticas febril por la presencia del fenol usado como preservante en la producción de los antivenenos (55). Aun cuando la IgY no activa el sistema de complemento, si está documentado en pacientes la hipersensibilidad a la albumina y otros componentes mayores del huevo, es más común en los niños (0,5-2% de la población pediátrica) (56, 57, 58, 59). A pesar de existir una posibilidad latente de reacción anafiláctica al antiveneno por IgY, en nuestro estudio ninguno paciente tuvo manifestaciones alérgicas al tratamiento durante el periodo de hospitalización. Queda por evaluar si existe hipersensibilidad tardía a la IgY del antiveneno, sobre todo en la población infantil para que esto no sea un factor que vaya a interferir con su esquema de vacunación.
AGRADECIMIENTOS
Al personal del hospital Universitario Alfredo Van Greiken, (HUAVG) donde se realizó el estudio. A la Secretaria de Salud del Estado Facón por el apoyo logístico y financiero para la investigación.
Al Centro de Investigaciones Tecnológicas de la Universidad Nacional Experimental “Francisco de Miranda” (CITEC-UNEFM)
Al Ministerio del poder popular para la Ciencia, Tecnología e Innovación (MPPCTI)
REFERENCIAS BIBLIOGRÁFICAS
- Programa de las Naciones Unidas para el Medio Ambiente (PNUMA). Oficina Regional para América Latina y el Caribe. REUNIÓN DE CANCÚN, MEXICO, 2012. Disponible en: https://web.archive.org/web/20120111115049/http://www.pnuma.org/ deramb/CancunMeeting.php.
- Leonardo De Sousa, Jessica BC, Mercedes Matos, Stefano Bónoli, Belsy Guerrero, Alexis R-A. Epidemiología del ofidismo en Venezuela (1996- 2004). Invest. clín jun. 2013; vol.54 no.2.
- Rengifo Cesar, Rodríguez Alexis. Serpientes, Venenos y Tratamiento Médico en Venezuela. Editorial Kindle. 2019; 5-11.
- Ministerio de Sanidad y Asistencia Social. Anuario de Epidemiologia y Estadística Vital. División de Enfermedades Transmisible y Accidentes. Departamento de Vigilancia Epidemiológica; 2000-2011.
- Johnson, J. & Dixon, J.R. Taxonomic status of the Venezuelan Macagua, Bothrops colombiensis. Journal of Herpetology 1984;, 18, 329−332.
- Markezich, A. & Taphorn, D. A variational analysis of populations of Bothrops (Serpentes: Viperidae) from Western Venezuela. Journal of Herpetology 1993; 27, 248–254.
- Markland FS. Snake venoms and the hemostatic system. Toxicon 1998; 36: 1749-1800.
- Mijares-Urrutia, A. & Arends, A.R. Herpetofauna of Estado Falcón, Northwestern Venezuela: a checklist with geographical and ecological data. Smithsonian Herpetological Information Service2000;, 123,1–30.
- Hospital Universitario Dr. Alfredo Van Greiken. Datos Estadísticos; Morbilidad de Emponzoñamiento Ofidio Según Municipio Año 2017- 2021. Servicio de Epidemiologia; 2021.
- Marco Natera, Luis Esqueda, Manuel Castelaín. Atlas Serpientes de Venezuela. Una visión actual de su diversidad. Imprenta Dimacofi, Chile. 2015; 303-305.
- Molina, C., Señaris, J.C. & Rivas, G. Los Reptiles del Delta del Orinoco”. Memoria de la Fundación la Salle de Ciencias Naturales 2003; 159−160, 235−264.
- Farsky S, Concalves LR, Cury Y. Characterization of local damage evoked by Bothrops jararaca venom in the rats connective tissue microcirculation: an intravital microscopy study. Toxicon 1999;37: 1079-1083.
- Guerrero EY, Rodríguez-Acosta A. Estudio clínico-epidemiológico de actividades hemorrágicas y necróticas causadas por el veneno de la serpiente de cascabel (Crotalus durissus cumanensis) en pacientes venezolanos. Rev Inst Nac Higiene2011;. 42 (2): 41-49.
- Gutiérrez JM, León G, Rojas G, Lomonte B, Rucavado A, Chaves F. Neutralization of local tissue damage induced by Bothrops asper (terciopelo) snake venom. Toxicon 1998; 36: 1529-1538.
- Calvete, J., Sanz, L., Cid, P., De la Torre, P., Flores-Díaz, M., Dos Santos, Borges, A., Bremo, A., Angulo, Y., Lomonte, B., Alape-Girón, A., Gutierrez, J. (2010): Snake venomics of the Central American rattlesnake Crotalus simus and the South American Crotalus durissus complex points to neurotoxicity as an adaptive paedomorphic trend along Crotalus dispersal in South America. J Proteome Res. 2010, 9(1): 528-44. doi: 10.1021/pr9008749.
- Bon C. The serum-therapy was discovered 100 years ago. Toxicon 1996; 34: 142-143.
- Laustsen, A.H., Gutiérrez, J.M., Knudsen, C., Johansen, K.H., Bermúdez-M, E., Cerni, F.A., Jürgensen, J.A., Ledsgaard, L., Martos- Esteban, A.,Øhlenschlæger, M., Pus, U., Andersen, M.R., Lomonte, B., Engmark, M., Pucca, M.B., 2018a.Pros and cons of different therapeutic antibody formats for recombinant antivenom development. Toxicon 146, 151–175. https://doi.org/10.1016/j.toxicon.2018.03.004.
- Otero-Patiño, R., Segura, Á., Herrera, M., Angulo, Y., León, G., Gutiérrez, J.M., Barona, J., Estrada, S., Pereañez, A., Quintana, J.C., Vargas, L.J., Gómez, J.P., Díaz, A., Suárez, A.M., Fernández, J., Ramírez, P., Fabra, P., Perea, M., Fernández, D., Arroyo, Y., Betancur, D., Pupo, Lady, Córdoba, E.A., Ramírez, C.E., Arrieta, A.B., Rivero, A., Mosquera, D.C., Conrado, N.L., Ortiz, R., 2012. Comparative study of the efficacy and safety of two polyvalent, caprylic acid fractionated [IgG and F(ab’)2] antivenoms, in Bothrops asper bites in Colombia. Toxicon 59, 344–355. https://doi.org/10.1016/j.toxicon.2011.11.017.
- Chippaux JP, Lang J, Eddinc SA, Fagot P, Rage V, Peyrieux JC, et al. Clinical safety of a polyvalent F(ab ́) 2 equine antivenom in 223 African snake envenomations: a field trial in Cameroon. VAO (Venin Afrique de l ́Ouest) Investigators. Trans R Soc Trop Med Hyg 1998; 92: 657-662.
- León G, Mongue M, Rojas E, Lomonte B, Gutiérrez JM. Comparison between IgG and F(ab’)2 polyvalent antivenoms: neutralization of systemic effects induced by Bothrops asper venom in mice, extravasation to muscle tissue, and potential for induction of adverse reactions. Toxicon 2001; 39: 793-801.
- León G, Valverde Jm, Rojas G, Lomonte B, Gutiérrez JM. Comparative study on the ability of IgG and F(ab) sheep antivenoms to neutralize local hemorrhage, edema and myonecrosis induced by Bothrops asper (terciopelo) snake venom. Toxicon 2000; 38: 233-244.
- Morais JF, De Freitas MCW, Yamaguchi IK, Dos Santos MC, Dias Da Silva WD. Snake antivenoms from hyperimmunized horses: comparison of the antivenom activity and biological properties of their whole IgG and F(ab ́) 2 fragments. Toxicon 1994; 32: 725-734.
- Vasquez, J. (2012): NEUTRALIZACIÓN DEL VENENO DE Bothrops asper CON PLANTAS DE LA FAMILIA ZINGIBERACEAE UTILIZADAS EN LA ETNOBOTÁNICA DEL ACCIDENTE OFÍDICO EN EL ORIENTE ANTIOQUEÑO. Trabajo de investigación presentado para optar al título de Magister en Ciencias Farmacéuticas. Posgrado en Ciencias Farmacéuticas y Alimentarias Facultad de Química Farmacéutica. Universidad de Antioquia.
- Alirol, E., Lechevalier, P., Zamatto, F., Chappuis,F., Alcoba, G., Potet, J., 2015. Antivenoms for snakebite envenoming: What is in the research pipeline? PLoS Negl. Trop. Dis. 9, 1–11. https://doi.org/10.1371/journal.pntd.0003896.
- Navarro, D., Vargas, M., Herrera, M., Segura, Á., Gómez, A., Villalta, M., Ramírez, N., Williams, D., Gutiérrez, J.M., León, G., 2016. Development of a chicken-derived antivenom against the taipan snake (Oxyuranus scutellatus) venom and comparison with an equine antivenom. Toxicon 120, 1–8. https://doi.org/10.1016/j.toxicon.2016.06.018.
- Organización Mundial de la Salud. Guía para la producción, control y regulación de inmunoglobulinas de antiveneno de serpientes. WHO 67th technical reports; 2017.
- Chippaux, J., Goyffon, M., 1991. Production and useof snake antivenin, in: Tu, A.T. (Ed.), Handbook of Natural Toxins, Vol. 5. Reptile Venoms and Toxins. Marcel Dekker, Inc., pp. 529–555.
- Chippaux, J.P., 2017. Snakebite envenomation turns again into a neglected tropical disease! J. Venom. Anim. Toxins Incl. Trop. Dis. 23, 1–2. https://doi.org/10.1186/s40409-017-0127-6.
- Leiva, C., Cangelosi, A., Mariconda, V., Farace, M., Geoghegan, P., Brero, L., Fernández-Miyakawa, M., Chacana, P. (2019): IgY-based antivenom against Bothrops alternatus: Production and neutralization efficacy. Toxicon, 163: 84-93.
- Rahman, S., Van Nguyen, S., Icatlo, F. C. Jr., Umeda, K. & Kodama, Y. (2013). Oral passive IgY-based immunotherapeutics.Human Vaccines & Immunotherapeutics 9, 1039–1048.
- Almeida, C., Da Silva, C., Pena, H., Cassia, R., Gitirana, D., Sentinelli, L., Liberman, T., Da Silva, W. (2008). Development of process to produce polyvalent IgY antibodies anti-African snake venom. Toxicon 52: 293–301.
- ORGANIZACIÓN PANAMERICANA DE LA SALUD (OPS). 28.a CONFERENCIA SANITARIA PANAMERICANA 2012. BIOÉTICA: HACIA LA INTEGRACIÓN DE LA ÉTICA EN EL ÁMBITO DE LA SALUD. CSP28/14, Rev. 1: 1-14. Disponible en https://iris.paho.org/bitstream/handle/ 10665.2/4457/CSP28-14 s.pdf?sequence=2&isAllowed=y.
- Polson, A. 1990. Isolation of IgY from the yolk of eggs by a chloroform-polyethylene glycol procedure. Immunol. Invest.19: 253- 258.
- Paradoa, M., Montoto, A. y Rodriguez, M. (1996): Cuantificación de Inmunoglobulinas mediante espectrofotometría. Revista cubana de pediatría. 69(2): 124-128.
- Laemmli, U.K., 1970. Cleavage of structural proteins during aSSIEmbly of the head of bacteriophage T4. Nature 227, 680–685.
- Takahashi T, Ohsaka A. Purification and characterization of a proteinase in the venom of Trimeresurus flavoviridis. Complete separation of the enzyme from hemorrhagic activity. Biochim Biophys Acta. 1970; 198(2): 293-307.
- Wells, M. A.; Hanahan, D. J. (1969) Studies on phospholipase A. I. Isolation and characterization of two enzymes from Crotalus adamantcus venom. Biochemistry 8, 414-424.
- Rafael Otero Patiño et al. Accidente botrópico en Colombia: estudio multicéntrico de la eficacia y seguridad de Antivipmyn-Tri®, un antiveneno polivalente producido en México. IATREIA 2007; vol 20, no. 3: septiembre.
- Shin, N. R., Choi, I. S., Kim, J. M., Hur, W. & Yoo, H. S. Effective methods for the production of immunoglobulin Y using immunogens of Bordetella bronchiseptica, Pasteurella multocida and Actinobacillus pleuropneumoniae. Journal of Veterinary Science2002; 3, 47-57.
- Shin J. H., Roe, I. H. & Kim, H. G. Production of anti-Helicobacter pylori urease-specific immunoglobulin in egg yolk using an antigenic epitope of H. pylori urease. Journal of Medical Microbiology2004; 53, 31-34.
- Hädge, D. & Ambrosius, H. Evolution of low molecular weight immunoglobulins. IV. Ig Y-like immunoglobulins of birds, reptiles and amphibians. Precursors of mammalian Ig A. Molecular Immunology1984; 21, 699-707.
- Hansen Wilber Murcia Gutierrez. Importancia de las inmunoglobulinas aviares y sus aplicaciones en inmunoensayos. Teoría y Praxis Investigativa Julio-Diciembre 2009; Volumen 4 – No. 2, Centro de Investigación y Desarrollo-CID / Fundación Universitaria de Área Andina.
- Sun, S., Mo, W., Ji, Y. & Liu, S. Preparation and mass spectrometric study of egg yolk antibody against rabies virus. Rapid Communication. Mass Spectrometry2001; 15, 708-712.
- Cardoso JLC, Fan HW, França FOS, Jorge MT, Leite SA, Nishioka SA, et al. Randomized comparative trial of three antivenoms in the treatment of envenoming by lance-headed vipers (Bothrops jararaca) in São Paulo, Brazil. Q J Med 1993; 56: 315-325. 2.
- Otero R, Gutiérrez JM, Rojas G, Núñez V, Díaz A, Miranda E, et al. A randomized blind clinical trial of two antivenoms prepared by caprylic acid or ammonium sulphate fractionation of IgG, in Bothrops and Porthidium snake bites in Colombia. Correlation between safety and biochemical characteristics of antivenoms. Toxicon 1999; 37: 895- 908.
- Otero R, Núñez V, Barona J, Díaz A, Saldarriaga M. Características bioquímicas y capacidad neutralizante de cuatro antivenenos polivalentes frente a los efectos farmacológicos y enzimáticos del veneno de Bothrops asper y Porthidium nasutumde Antioquia y Chocó. Iatreia 2002; 15: 5 -15.
- Pardal PPO, Souza SM, Monteiro MRCC, Fan HW, Cardoso JLC, França FOS, et al. Clinical trial of two antivenoms for the treatment of Bothrops and Lachesis bites in the north eastern Amazon region of Brazil. Trans R Soc Trop Med Hyg 2004; 98: 28-42.
- Theakston RDG, Fan HW, Warrell DA, Dias DA Silva WD, Ward SA, Higashi HG, et al. Use of enzyme immunoassays to compare the effect and assess the dosage regimens of three Brazilian Bothrops antivenoms. Am J Trop Med Hyg 1992; 47: 593-604.
- Boyer LV, Seifert SA, Cain JS. Recurrence phenomena after immunoglobulin therapy for snake envenomations: Part 2. Guidelines for clinical management with crotaline Fab antivenom. Ann Emerg Med 2001; 37: 196-201.
- Masci PP, Mirtschin PJ, Nias TN, Turnbull RK, Kuchel TR, Whitaker AN. Brown snakes (Pseudonaja genus): venom yields, prothrombin activator neutralization and implications affecting antivenom usage. Anaesth Intensive Care 1998; 26: 276-281.
- Talita Bavaresco, Maira Alana Hollmann, Thiago Fucuta de Moraes, Fernanda C-S, Carla Brugin Marek. Acidente ofídico grave atendido em um hospital escola – Relato de caso 6to Congresso de Ciencias farmacéuticas do Mercosul. Noviembre 2016.
- Seifert SA, Boyer LV. Recurrence phenomena after immunoglobulin therapy for snake envenomations: Part 1. Pharmacokinetics and pharmacodynamics of immunoglobulin antivenoms and related antibodies. Ann Emerg Med2001; 37: 189-195.
- Almeida, C. M. C., Quintana-Flores, V. M., Medina-Acosta, E., Schriefer, A., Barral-Neto, M. & Días da Silva, W. Egg yolk anti-BfpA antibodies as a tool for recognizing and identifying enteropathogenic Escherichia coli. Scandinavian Journal of Immunology 2003; 57, 573-582.
- Sunwoo, H. H., Lee, E. N., Menninen, K., Suresh, M.R. & Sim, J. S. Growth Inhibitory Effect of Chicken Egg Yolk. Antibody (IgY) on Escherichia coli. Journal of Food Science2002; 67, 1486-1494.
- García M, Monge M, León G, Lizano S, Segura E, Solano G, et al. Effect of preservatives on IgG aggregation, complement-activating effect and hypotensive activity of horse polyvalent antivenom used in snakebite envenomation. Biologicals 2002; 30: 143-151.
- Bock SA. Prospective appraisal of complaints of adverse reactions to foods in children during the first 3 years of life. Pediatrics 1987; 79:683-688.
- Boyano-Martínez T, García-Ara C, Díaz-Pena JM, Martín- Esteban M. Prediction of tolerance on the basis of quantification of egg white- specific IgE antibodies in children with egg allergy. J Allergy Clin Immunol 2002; 110:304-309.
- Góngora-Meléndez MA, Magaña-Cobos A, Montiel-Herrera JM, Pantoja-Minguela CL y col. Alergia a las proteínas del huevo en edad pediátrica. Revista Alergia México2015; 62:234-250.
- Savage JH, Matsui EC, Skripak JM, Wood RA. The natural history of egg allergy. J Allergy Clin Immunol 2007; 120:1413- 1417.
- Karen Sarmiento, Adriana Sarmiento, William Quevedo-Buitrago, Ivonne Torres, Carolina Ríos, Patricia Hidalgo-Martínez, et al. Comparison of the Effectiveness, the Safety, and the Pharmacokinetic of Snakebites Antivenoms: Review. Universitas Medica (2020), vol. 61, núm. 1.


AUTORES
Rengifo G. Cesar1 Yrausquin José,3, Duno Angel,2,3, Reyes Imelda1,
Bello Alfredo,3, Guerra Uslar2, Trujillo Lesbia2, Guillén Alejandro2,
Bremo Adolfo1,3
- Programa de Medicina, Ciencias de la Salud, UNEFM
- Programa de Ciencias Veterinarias, Ciencias del Agro y del Mar, UNEFM
- Centro de investigaciones tecnológicas (CITEC), UNEFM
Correo: rengifotocicologia@gmail.com

