Virus de inmunodeficiencia humana
Introducción
El VIH fue aislado por primera vez del ganglio de un enfermo con linfadenopatía persistente generalizada en 1983 por el grupo de L. Montagnier, en el Instituto Pasteur de París. Por más de 25 años la autoría del descubrimiento del VIH como agente etiológico del Sida fue polémica, sin embargo, se clarificó en 2008 con la concesión de Premio Nobel de Medicina a Luc Montagnier y Francoise Barré-Sinousi como codescubridores del virus.
En 1986, el grupo de F. Clavel también del Instituto Pasteur de París, describió una nueva especie del VIH en enfermos de África occidental, denominado VIH-2. Los VIH pertenecen al género Lentivirus y presentan varios genes reguladores (tat, rev, nef, vif, vpr y vpu).
Origen y variabilidad
Los análisis filogenéticos han mostrado que el origen del VIH-1 está asociado al SIV cpz que infecta al chimpancé Pan troglodytes troglodytes (grupos M y N) y de los gorilas en la especie Gorilla gorilla (grupo O). Por su parte, el VIH-2 proviene del SIV smm cuyo hospedero es el Sooty mangabey.
El VIH ha ido diversificándose en humanos a causa de sus elevadas tasas de mutación y recombinación, lo que ha dado lugar a una compleja filogenia que va enriqueciéndose progresivamente a medida que se caracterizan nuevos aislamientos provenientes de varias partes del mundo. En el VIH-1, hay tres grandes grupos: M (Main o principal), O (Outlier o externo) y N (No-M, No-O). De todos el mayoritario es el M, engloba más del 97% de las infecciones en todo el mundo. Dentro de él, se distinguen hasta el momento 9 subtipos (A, B, C, D, F, G, H, J y K) y más de 30 formas recombinantes circulantes.
El ciclo replicativo del VIH se puede dividir en dos fases, la temprana o preintegración (desde la interacción del virus con la célula blanco hasta la integración del DNA viral en el genoma del hospedador) y la fase tardía o postintegración (desde la transcripción del genoma proviral hasta la liberación y maduración del virión).
Aspectos de la patogenia de la infección
La infección por el VIH es fundamentalmente una afectación del sistema inmune, donde el principal blanco del virus son los linfocitos T CD4, aunque otros tipos celulares como linfocitos T CD8, macrófagos, células dendríticas y células del sistema nervioso central pueden verse infectados con menor eficacia. La eliminación progresiva del pool de linfocitos T CD4 del paciente es lo que caracteriza la infección por el VIH, y es lo que conduce finalmente al desarrollo de enfermedades que definen la aparición del Sida.
Hay factores que influyen en la patogenia, entre ellos factores virales como la alta tasa de error de la enzima transcriptasa del virus que hace que en cada ciclo de replicación se introduzcan más mutaciones con alta variabilidad genética del VIH, con un elevado recambio de linfocitos T CD4, estimándose una vida media de 6 horas, con un recambio diario de aproximadamente 100 millones de linfocitos T CD4. También efectos citopáticos, apoptosis, con respuestas autoinmunes con reactividad cruzada y producción de anticuerpos antilinfocitarios.
Hay factores del huésped que influyen en el curso de la infección, entre ellos la existencia de un alelo mutante con delección de 32 pares de bases en el gen que codifica para el correceptor CCR5, otros factores favorecen la progresión de la enfermedad como el haplotipo HLA, producción de quimiocinas, entre otros. Tanto en la fase aguda como en la crónica de la infección existen interacciones virus-huésped. En la infección por el VIH la respuesta inmune de tipo celular probablemente juega un papel más importante que la humoral.
Pruebas diagnósticas
El diagnóstico sólo puede establecerse de modo definitivo mediante métodos de laboratorio, ya que las manifestaciones clínicas aunque sugestivas, no son específicas. La metodología más frecuentemente usada es la detección de anticuerpos en suero o fluidos biológicos. Su presencia no significa exposición y erradicación inmune en el pasado, sino estado de portador actual.
Los métodos de laboratorio incluyen métodos directos como el cultivo viral, detección de ácidos nucleicos y antigenemia; e indirectos, como detección de anticuerpos especificos (pruebas serológicas) e investigación de la inmunidad celular específica.
Las pruebas serológicas, incluyen pruebas de screening como el ELISA (enzimoinmunoanálisis) y de confirmación como el WB (Western Blot), IFI (inmunofluorescencia indirecta), RIPA (radioinmunoprecipitación) y LIA (inmunoanálisis de tipo lineal). Hay pruebas de detección rápida, como las de inmunoadherencia (dot-blot). El más usado es el WB para el VIH-1, resultando positivo según recomendaciones de la OMS por presentar al menos dos bandas de la envoltura del virus.
Es importante conocer la clasificación del VIH usada preferiblemente en Venezuela, según el CDC (1993). En esta clasificación, todas las categorías son excluyentes y el paciente debe clasificarse en la más avanzada posible. La definición de casos para la vigilancia ampliada del CDC de 1993, incluye todo lo que ya contenía la definición de 1987 más las personas con infección comprobada y cualquiera de los siguientes:
- Recuento de linfocitos T CD4 menor de 200 cel/mm3 (menos de 15%),
- TB pulmonar,
- Neumonía recurrente (2 o más episodios en un año) o
- Carcinoma cervicouterino invasivo.
Las categorías clínicas son tres:
- Categoría A: Dada por la infección primaria y los pacientes asintomáticos con o sin linfadenopatía generalizada persistente (LGP).
- Categoría B: En los pacientes que presentan o han presentado enfermedades relacionadas con VIH (no pertenecientes a la categoría A o C) cuyo manejo o tratamiento puedan verse complicados debido a la presencia de la infección por VIH. Ejemplos: Angiomatosis bacilar, Candidiasis oral, Candidiasis vulvovaginal persistente frecuente o que no responden al tratamiento, Displasia cervical o carcinoma in situ, Temperatura superior de 38,5O C, Diarrea de más de un mes de duración, Leucoplasia oral vellosa, Herpes zoster (dos episodios o uno que afecte a más de un dermatoma), Púrpura trombocitopénica idiopática (PTI), Listeriosis, Enfermedad inflamatoria pélvica, Neuropatía periférica.
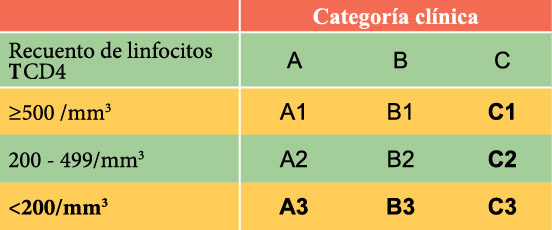
- Categoría C: En los pacientes que presenten o hayan presentado alguna de las complicaciones ya incluidas en la definición de SIDA y no existan otras causas de inmunodeficiencia que puedan explicarla. En esta categoría están: Candidiasis traqueal, bronquial, pulmonar o esofágica, Criptococosis extrapulmonar, Criptosporidiasis o Isosporidiasis con diarrea más de un mes, Infección por Citomegalovirus (CMV) en el niño de más de un mes de edad (en otra localización distinta a hígado, bazo o ganglios linfáticos), Retinitis por CMV, Encefalopatía por VIH, Herpes simple (HS) que causa una úlcera cutánea de más de un mes de evolución, bronquitis, neumonitis o esofagitis de cualquier duración, que afecten a un paciente de más de un mes de edad, Histoplasmosis diseminada (HD), Sarcoma de Kaposi (SK), Linfoma de Burkitt o equivalente, Linfoma inmunoblástico o equivalente, Linfoma cerebral primario o equivalente, TB pulmonar, extrapulmonar o diseminada, Infección por M. avium intracelular o M. kansasii diseminada o extrapulmonar, Infección por otras microbacterias extrapulmonar o diseminada, Neumonía por P. jirovecii (PCP), Neumonía recurrente (más de 2 episodios/año), Leucoencefalopatía multifocal progresiva (LMP), Sepsis recurrente por Salmonella sp diferente a S. typhi, Toxoplasmosis cerebral, Síndrome de desgaste, Carcinoma de cuello uterino invasivo, Coccidiomicosis diseminada (en una localización diferente o además de la pulmonar o los ganglios linfáticos cervicales o hiliares). Las categorías inmunológicas del VIH, se evidencian en la siguiente tabla.
- Categoría 1: Recuento de linfocitos T CD4 mayor o igual a 500 cel/mm3 en número absoluto o mayor o igual al 29%.
- Categoría 2: Recuento de linfocitos T CD4 entre 200 y 499 cel/mm3 o entre 14 – 28%.
- Categoría 3: Recuento de linfocitos T CD4 menor de 200 cel/mm3 o menor del 14%.
Los cuadros resaltados C y recuento de linfocitos T CD4 menor de 200 cel/mm3 o bien porcentaje de linfocitos T CD4 menor del 14%, indican expansión de la definición de vigilancia del SIDA. Las categorías A3, B3 y C deben notificarse como SIDA.
Tratamiento antirretroviral (TARV)
El TARV de combinación ha revolucionado el tratamiento de la infección por el VIH, al cambiar la realidad del VIH/Sida, lo que ha conllevado a una reducción dramática de la morbilidad, la mortalidad y la necesidad de hospitalizaciones. Ha dejado de ser una enfermedad mortal hasta convertirse en crónica. No se erradica la infección, ya que la replicación viral continúa en el tejido linfoide, pero se controla con medicamentos antirretrovirales combinados. La inhibición duradera de la replicación viral con el consiguiente aumento en el recuento de CD4 revierte la evolución de la enfermedad incluso en personas con el VIH en estado avanzado de infección.
Tras más de 25 años de estudios clínicos con antirretrovirales efectuados en los más diversos estadios de la evolución de la infección por el VIH y utilizando fármacos tanto en monoterapia como en combinaciones de dos o más medicamentos, puede establecerse en el momento actual que el TARV se basa en la combinación de al menos tres medicamentos.
La elección de estos 3 antirretrovirales (ARVs) fundamentalmente dependerá de la evidencia científica disponible, la situación del paciente (clasificación clínico/inmunológica) y de si el paciente es naive al TARV o si ha sido tratado previamente.
Los objetivos del TARV son:
- Virológico: Reducir la carga viral plasmática (CVP) a niveles indetectables en el menor tiempo posible (ideal 4-6 meses posterior al inicio o cambio de tratamiento) y mantener esta reducción en forma prolongada.
- Inmunológico: Restaurar y preservar la función inmunológica tanto cuantitativa (aumento del recuento de linfocitos T CD4) como cualitativa (respuesta inmunológica antígeno-específica).
- Clínico: Reducir la morbimortalidad y mejorar la calidad de vida del paciente.
- Epidemiológico: Reducir la transmisión de la infección.
Las estrategias para lograr estos objetivos incluyen:
- Selección adecuada de un esquema combinado de ARVs.
- Preservación de opciones futuras de TARV.
- Secuenciación adecuada de los ARVs.
- Mejorar la adherencia o apego al TARV y disminuir el riesgo de aparición o severidad de efectos adversos (EAs).
- Información al paciente, sobre la importancia de cumplir su TARV.
Es importante que se conozca que en Venezuela, en todos los estados existen consultas de VIH/Sida, con médicos especialistas en Infectología o Inmunología, con algunas excepciones, donde médicos Internistas con entrenamiento en el tema son quienes evalúan a las personas infectadas por el VIH/Sida. En todo el pais existen coordinaciones regionales por el Ministerio del Poder Popular para la Salud (MPPS) y también por el Instituto Venezolano de los Seguros Sociales (IVSS) en 8 estados.
En todo el pais existen farmacias y/o depósitos de ARVs donde se dispensan los TARV en forma gratuita con equidad sin distinción. Estos son adquiridos por el estado venezolano y distribuidos en todo el pais para ser dispensados a toda aquella persona que lo requiera, venezolano que viva en el pais y extranjero que demuestre vivir en el pais.
También se dispensan, los tratamientos para las Infecciones de Transmisión Sexual (ITS), IO, neoplasias como Sarcoma de Kaposi (SK), comorbilidades como Tuberculosis (TB), Virus de Hepatitis B y C (VHB y VHC), suplementos nutricionales en pacientes con Síndrome de desgaste, sucedáneos de la leche materna para niños menores de 1 año infectados o expuestos al VIH, kit de bioseguridad para cesáreas u otro procedimiento quirúrgico a una persona infectada por el VIH, profilaxis posexposición laboral y no laboral (PPE y PPE no L), realización de pruebas diagnósticas y de seguimiento (pruebas rápidas VIH, ELISA VIH, confirmatorios WB, CD4, CV, test resistencia, PCR en niños expuestos).
En el país existe una guía de TARV del paciente VIH/Sida actualizada, en su 4ta edición, con validez del 2010-2012, además de consensos y guías en relación a temas como: Adherencia, nutrición, trastornos metabólicos, VHB, VHC, TB, IO, neoplasias, bioseguridad, PPE y PPE no L, manejo de pacientes con VIH en caso de emergencias, riesgo cardiovascular, embarazadas con VIH, inmunización en niños con VIH, entre otras disponibles en la pagina web del MPPS, Sociedad Venezolana de Infectología (SVI) e impresas a través de las coordinaciones regionales.
Parámetros clínicos y de laboratorio previo al inicio del TARV
El paciente con infección por VIH debe ser evaluado como cualquier persona que presente una enfermedad general, lo cual permitirá conocer su situación basal y posibles comorbilidades asociadas.
Esta evaluación médica inicial es de gran importancia, una vez diagnosticada la infección por VIH y evaluada la condición clínica del paciente debe descartarse la presencia de Infecciones Oportunistas (IO), neoplasias asociadas y otras enfermedades concomitantes, con la finalidad de definir la necesidad de inicio de profilaxis o tratamiento de IO y/o TARV. También se podrá evaluar y reforzar la capacidad de comprensión y adherencia o apego del paciente al TARV, haciéndose necesario que en las consultas de VIH o en los servicios de Infectología también se proporcione información sobre el VIH/SIDA y cómo prevenir su trasmisión.
Es importante en esta consulta inicial, realizar una historia clínica y considerar los exámenes paraclínicos necesarios dependiendo del caso. La historia clínica debe hacer énfasis en:
- Fecha de la primera serología positiva para el VIH y tipo de prueba realizada. En caso de contar con serologías previas negativas, es importante revisarlas ya que ayudarán a identificar casos de infección reciente o aguda.
- Precisar antecedentes de infecciones de transmisión sexual (ITS) o de vacunación.
- Interrogar al paciente, acerca de si conocía su diagnóstico previamente. Revisar los resultados del recuento de linfocitos T CD4 y de la CVP, si están disponibles.
- Si el paciente ya ha recibido TARV, debe obtenerse la historia de ARVs (detalles sobre los diferentes esquemas recibidos), la posología, el tiempo de administración y el motivo del cambio (intolerancia, toxicidad, falla).
- Historia de las IO y/o neoplasias asociadas al VIH que ha padecido el paciente así como el tratamiento o profilaxis indicado y/o cumplido para estas.
- Identificación de comorbilidades: Uso de sustancias ilícitas, Hepatitis B ó C (VHB o VHC) crónica activa, Tuberculosis (TB), Diabetes mellitus (DM) e hiperlipidemia, riesgo cardiovascular (CV), entre otras.
- Describir la sintomatología del paciente presentada antes o al momento.
- Antecedentes familiares de importancia (DM, hipertensión arterial (HTA), enfermedad cardiovascular (ECV), entre otras).
Es de gran valor para la casuística del país, la notificación del caso al componente de vigilancia epidemiológica del programa nacional de SIDA/ITS del MPPS, llenando la ficha respectiva, con énfasis en las probables conductas de riesgo para la infección por el VIH: Hombres que tienen sexo con hombres (HSH) o heterosexual con conductas de riesgo, transfusión de productos sanguíneos, o sospecha de transmisión materno-infantil (TMI) o transmisión vertical (TV). Esa notificación es independiente de la solicitud del TARV y contribuirá a tener datos sobre el número de casos nuevos diagnosticados.
La Exploración física debe ser minuciosa y completa, incluida el área genital. Los exámenes a solicitar en esta consulta inicial son:
- Confirmación de la infección por el VIH.
- Hematología completa, LDH, transaminasas, bilirrubina total y fraccionada, proteínas, funcionalismo renal y perfil lipídico.
- VDRL cualitativo y cuantitativo.
- PPD.
- Serología para hepatitis A, B y C.
- Serología toxoplasmosis (anti IgG) y serología para hongos. • Recuento de linfocitos T CD4 y CVP.
- Radiografía de tórax (si por clínica lo amerita).
- Citología vaginal, si es mujer.
Las recomendaciones especiales incluyen: evaluación oftalmológica si el recuento de linfocitos T CD4 es < 200 cel/mm3 y evaluación psicológica, con apoyo individual y/o de grupo.
Seguimiento de los pacientes con TARV
En las visitas de seguimiento se debe realizar un examen físico detallado, investigar sobre EAs de los ARVs, seguir informando y promocionando la adherencia o apego como componente fundamental para el éxito del TARV, insistir en la prevención, tomar decisiones sobre las profilaxis e inmunizaciones requeridas así como la realización de los exámenes de laboratorio para monitorizar la toxicidad de los ARVs con control de su evolución clínica, incluso aún antes de que se presenten síntomas en los pacientes con VIH/SIDA.
En caso de que en esta(s) primera(s) consulta(s) el paciente no tenga criterios de inicio de TARV o no desea iniciarlo en el momento actual, debemos evaluarlo clínicamente cada 4 a 6 meses, buscando datos de progresión de enfermedad. Debe solicitarse el recuento de linfocitos T CD4 cada 6 meses o antes si presenta datos clínicos de progresión de la enfermedad, considerando también los exámenes de laboratorios adicionales según requerimientos del paciente y criterio médico. La evaluación psicológica y socio-familiar es muy importante y sin lugar a dudas será vital en la adherencia al TARV.
Los exámenes que deben realizarse:
- Hematología completa: Si utiliza AZT (mínimo cada 3 meses).
- Examen general de orina y control de BUN/Creatinina: Si utiliza Tenofovir (mínimo cada 3 meses).
- Control de Glicemia y perfil lipídico: Si utiliza esquemas basados en IP/r (por lo menos cada 6 meses).
- Transaminasas: Cada 3 meses, en caso de utilizar IP/r o ITRNN.
- Control de amilasas: Sobre todo en caso de estar cumpliendo DDI (cada 6 meses).
- PPD y VDRL: Anualmente y citología: Vaginal cada 6 meses, así como solicitar anualmente aquellas serologías consideradas por el médico. Citología rectal dependiendo del caso.
Inicio de TARV
La decisión de iniciar TARV debe basarse principalmente en el recuento de linfocitos T CD4 y en la sintomatología. Debe evaluarse individualmente cuándo iniciarlo y la combinación recomendada. La disposición del paciente, su motivación y la comprensión de la importancia del TARV y la adherencia al mismo es esencial. En los pacientes con infección por VIH sintomática (eventos B y C de la clasificación del CDC) se recomienda iniciar TARV. En pacientes asintomáticos el inicio se basará en el recuento de linfocitos T CD4, la presencia de comorbilidades y las características individuales del paciente. En algunos casos se considerará la CVP.
Es valioso saber que:
- El recuento de linfocitos de CD4, es el mayor indicador clínico de inmunocompetencia, es el parámetro más importante para decidir iniciar el TARV. El recuento de linfocitos T CD4 determina cuándo iniciar el TARV, la evaluación de la respuesta terapéutica y la necesidad de profilaxis para la prevención de las IO.
- La carga viral plasmática (CVP) es el parámetro principal para evaluar la eficacia del TARV y definir sus fallas al mismo, permitiendo decidir cambio de tratamiento. Actualmente, la CVP es un criterio secundario para el inicio del TARV, complementario al recuento de linfocitos T CD4 .
Es esencial la evaluación de un especialista en VIH para decidir iniciar TARV y/o profilaxis para IO u otra medicación. Las excepciones se discutirán según la guía de tratamiento y/o estudios publicados, con el Programa Nacional de SIDA/ITS del MPPS.
Indicación de inicio de TARV:
- Con síntomas atribuibles a la infección por VIH o que hayan padecido cualquier evento que defina SIDA (incluyendo trombocitopenia persistente sin otra causa) independientemente del recuento de linfocitos T CD4 y/o CVP.
- Con recuento de linfocitos T CD4 menor de 350 cel/mm3 y/o menor de 15%: Estudios clínicos han demostrado que estos pacientes tienen menor riesgo de mortalidad o eventos definitorios de SIDA, en comparación con aquellos que inician con un recuento de linfocitos T CD4 menores a 200 cel/mm3. Adicionalmente se ha podido demostrar que la respuesta inmunológica y virológica a largo plazo es mejor en pacientes que inician el TARV con un número mayor de recuento de linfocitos T CD4.
- Con recuento de linfocitos T CD4 de 350-500 cel/mm3.
- Con antecedentes de una enfermedad cardiovascular (ECV) o tengan factores de riesgo (FR) que favorezcan su aparición. Los factores mayores de riesgo cardiovascular: Hipertensión arterial, Tabaquismo, Obesidad (IMC ≥ 30), Inactividad física o sedentarismo, Dislipidemia, Diabetes mellitus, Microalbuminuria o filtración glomerular estimada <60 ml/min, Edad (>55 años para hombres, >65 años para mujeres), Historia familiar de enfermedad cardiovascular prematura (hombres <55 años o mujeres <65 años). La infección por VIH, en este momento se considera un FR cardiovascular independiente a los factores de riesgo clásicos de ECV. En el estudio SMART se evidenció que aquellos pacientes que descontinuaban el TARV presentaban inmediatamente elevación de marcadores inflamatorios de enfermedad endotelial y la elevación de los mismos estaban relacionados con incremento de la morbilidad e incluso de la mortalidad.
- Si la CVP es > 100.000 copias RNA/ml, debiendo individualizarse los casos.
- Si hay un descenso de un recuento de linfocitos T CD4 de más de 100 cel/mm3 por año. Señalando los valores previos que demuestren este cambio en el recuento. Evaluando cambios en el índice CD4+/CD8+.
- Existen consideraciones especiales:
- Con coinfección con el Virus de Hepatitis B (VHB) y que requieran TARV y/o para la Hepatitis B crónica activa.
- Con coinfección con el Virus de Hepatitis C (VHC).
- Embarazadas independientemente de la CVP y del recuento de linfocitos T CD4, con el objeto de evitar la transmisión materno-infantil (TMI).
- Con diagnóstico de nefropatía asociada al VIH, independientemente del recuento de linfocitos T CD4 y de la CVP, ya que el TARV retarda la progresión de la nefropatía.
- Con enfermedad neoplásica.
- Parejas serodiscordantes en relaciones estables: Debe evaluarse y discutirse cuidadosamente el inicio del TARV para disminuir la transmisión por vía sexual, previo consentimiento de la persona a recibirlo.
- Pacientes mayores de 55 años: Ya que estudios clínicos han mostrado que la progresión a SIDA es más rápida en pacientes VIH mayores de 55 años con menor pronóstico de vida al compararlos con pacientes de la misma edad sin infección por el VIH. La edad se considera un FR independiente de progresión a SIDA.
El TARV inicial debe ser individualizado y beneficiar al mayor número de pacientes considerando:
- Potencia: Ensayos clínicos que demuestran efectos sostenidos en disminución de la CVP y elevación del contaje de linfocitos T CD4.
- Conveniencia: Número de tabletas/día, actividades del paciente, frecuencia de dosis y relación con las comidas.
- Que favorezca la mayor adherencia posible.
- Consideración de co-morbilidades, por ejemplo: Riesgo o presencia de ECV, Depresión, DM, TB, Hepatitis B o C crónica, entre otras.
- Evaluación de interacciones con otros medicamentos y los posibles efectos adversos asociados.
- Sexo y deseo o posibilidad de embarazo.
Existen medicamentos ARVs de 5 familias distintas en el país.
Inhibidores de la transcriptasa reversa nucleósidos (ITRN)
En Venezuela, están registrados cinco (5) ITRN: Lamivudina (3TC), Didanosina (DDi), Zidovudina (AZT ó ZDV), Abacavir (ABC) y Stavudina (D4T). Hay tres (3) combinaciones (coformulaciones):
Abacavir-Zidovudina-Lamivudina, Abacavir-Lamivudina, Tenofovir-Emtricitabina y Zidovudina-Lamivudina y un (1) ITR nucléotido, Tenofovir (TDF). Ya no se comercializa Zalcitabina.
Inhibidores de transcriptasa reversa no nucleósidos (ITRNN)
En Venezuela, están registrados tres (3) ITRNN: Nevirapina (NVP), Efavirenz (EFV) y Etravirina (ETRV). Sólo NVP y EFV son considerados en inicio de TARV.
Estos medicamentos inhibidores de la transcriptasa reversa actúan como sustratos alternativos y compiten con los nucleósidos fisiológicos, de los que difieren únicamente en cambios mínimos en la molécula de la ribosa. Sus efectos tóxicos característicos suelen aparecer a largo plazo, en forma de toxicidad de la médula ósea, lipoatrofia, neuropatía, pancreatitis y en ocasiones acidosis láctica (por toxicidad mitocondrial).
Inhibidores de proteasa (IP)
En Venezuela, están registrados seis (6) IPs: Atazanavir (ATV), Darunavir (DRV), Fosamprenavir (FPV), Lopinavir (LPV), Saquinavir (SQV), Ritonavir (RTV). DRV/r no está aprobado para pacientes sin tratamiento previo. Actualmente, en el país y en el mundo no se comercializa Nelfinavir, ni Indinavir ni Amprenavir.
La elección final del IP se basará en los datos de eficacia, tolerancia, toxicidad asociada, requerimientos alimentarios, interacciones medicamentosas, posología y farmacocinética. En Venezuela se considera que los IP/r SÓLO SE RECOMIENDAN en aquellos casos en los que exista contraindicación justificada para el uso de los ITRNN o en los pacientes que presenten intolerancia o EAs severos inducidos por los ITRNN y que sean REPORTADOS por el médico tratante.
Es importante tener en cuenta que las guías de TARV del país, han tomado en cuenta en relación a los IP, el concepto preferente y alternativos basado en: La eficacia virológica no inferior o superior cuando se compara con otro esquema de IP/r a las 48 sem, que exista la posibilidad de menos dosis de RTV al día, las complicaciones metabólicas asociadas, las dosis diarias y el número de tabletas al día, así como su tolerancia.
Los IP bloquean la proteasa del VIH, impidiendo la maduración de las proteínas virales e inhibiendo de forma potente la replicación viral. La proteasa es una enzima que actúa fragmentando las proteínas precursoras de gag y gag-pol para formar los componentes polipeptidicos virales funcionales. La inhibición de la proteasa no impide que se sinteticen los grandes polipéptidos virales codificados por gag y gag-pol, pero al no fragmentarse no son funcionales y no se producen virus con capacidad infectiva. Deben potenciarse con bajas dosis de Ritonavir.
Tienen efectos adversos especialmente la intolerancia digestiva (náuseas, vómitos, diarrea), las alteraciones metabólicas (dislipidemia, resistencia a la insulina, hiperglicemia) y las alteraciones en la distribución de la grasa corporal (lipoatrofia, lipohipertrofia).
El inicio de TARV con esquemas basados en ITRNN o IP/r, tiene ventajas y desventajas:
La ventaja principal de los ITRNN es su conveniencia por el menor número de tabletas y que se puede tomar una vez al día en el caso de EFV, lo que contribuye a la adherencia al TARV y favorece una mejor respuesta, con una eficacia virológica comprobada similar o mayor a los IP/r, aún en pacientes con CVP altas e inmunodeprimidos severos, adicional el menor costo anual por esquema lo que hace más factible que un número mayor de pacientes disponga de tratamiento en el pais.
Se recomienda de inicio en este consenso; dado su barrera genética baja, la situación en que están más indicados los ITRNN es en los pacientes sin tratamiento previo y sin sospecha de resistencia primaria. La ventaja principal de los IP/r es su barrera genética alta para el desarrollo de resistencia ARV. En la mayoría de los estudios clínicos que comparan el uso de ITRNN vs IP/r, la elevación del recuento de linfocitos T CD4, ha sido mayor incluso en valores estadísticamente significativos con los IP/r.
Inhibidores de integrasa (II)
En Venezuela, está registrado un (1) Inhibidor de Integrasa: Raltegravir (RALT o RTG). Este es un ARV inicialmente indicado para pacientes multitratados y multiresistentes con excepciones (situaciones extremadamente especiales) que DEBEN ser discutidas con el Programa Nacional de SIDA/ITS del MPPS. La integrasa es una enzima esencial que cataliza la unión del DNA viral del VIH producto de la transcripción reversa con el DNA genómico de la célula huésped. La integración del DNA del VIH es necesaria para la persistencia de la infección. Los II inhiben la transferencia de cadena, y alteran la función enzimática a través de la interacción con el sitio catalítico. La mayoría de los efectos adversos son leves.
Inhibidores de entrada (IE)
Enfuvirtide o T20 representa el primer IE aprobado para uso clínico, disponible en el país desde el 2005. Este ARV tiene a la proteína gp41 como la principal responsable de su mecanismo de acción, el cual implica mimetizar la región HR2 de gp41, competiría con la HR2 viral por la unión a HR1. Se une a la HR1 de gp41 e impide la formación de la estructura de seis hélices, que es crítica para la fusión de las membranas del VIH a la célula y la formación del poro de fusión.
En algunos países existen también los antagonistas de los correceptores, Maraviroc, no disponibles por el momento en el pais.
Esquemas de tarv que no deben ser utilizados
- Monoterapia con ITRN: Se sugiere no emplear estos ARVs como tratamiento único ya que no logran alcanzar actividad antiviral potente y sostenida.
- Esquemas con dos ITRN únicamente (Biterapia): No se recomiendan más, por la falta de respuesta virológica potente y sostenida.
- Tratamiento con tres ITRN únicamente: No suelen recomendarse debido a una actividad virológica subóptima o ausencia de suficientes datos que apoyen su uso. En situaciones excepcionales, podría utilizarse la combinación de AZT+3TC+ABC. Con la combinación de AZT+3TC+TDF aunque en el DART se demostró actividad antiviral, no hay datos comparativos disponibles por lo que de rutina en la práctica clínica no debe usarse.
- Esquemas con IP solos: Aun cuando existen estudios que evalúan a LPV/r, ATV/r, DRV/r como monoterapia, por el momento no se sugiere su empleo rutinario, fuera del marco de protocolos de investigación con seguimiento estricto.
Componentes de TARV que no deben ser utilizados
- Atazanavir + Indinavir: Ambos pueden causar hiperbilirrubinemia e ictericia y, al parecer, sus EAs son aditivos cuando se usan en combinación.
- Didanosina + Stavudina: Su uso combinado se asocia a mayor riesgo de Neuropatía Periférica, Pancreatitis y Acidosis Láctica. Se han reportado algunas muertes por ácidosis láctica en embarazadas con VIH que recibían esta combinación.
- 2 ITRNN: En el estudio 2NN, los pacientes que iniciaron TARV con NVP vs EFV vs NVP+EFV en combinación con D4T+3TC se observó una mayor frecuencia de EAs que conllevó al abandono del TARV en el grupo con 2 ITRNN, por lo que se sugiere NO emplear combinaciones de 2 ITRNN en ningún esquema de TARV.
- Stavudina + Zidovudina: Es una combinación antagónica, tanto in vivo como in vitro.
Componentes de TARV no sugeridos como inicio de tratamiento
- Abacavir + Zidovudina + Lamivudina: Su eficacia virológica es significativamente menor en comparación a los esquemas con ITRNN o IP/r recomendados.
- Didanosina + Tenofovir: Presenta una tasa elevada de FV temprana. Se asocia a una selección acelerada de cepas virales mutantes, así como a un mayor riesgo de toxicidad mitocondrial. Adicionalmente, se ha observado un descenso en el recuento de linfocitos T CD4 y/o falla en su incremento en algunos pacientes, aún si reciben dosis ajustadas de DDI.
- Stavudina + Lamivudina: Presenta toxicidad significativa: Lipoatrofia, Neuropatía periférica, Hiperlactemia, Ácidosis láctica.
- Enfuvirtide y Etravirina: Existen datos insuficientes para inicio de TARV.
- Darunavir: No recomendado en Venezuela como terapia de inicio.
El éxito terapéutico del primer esquema de TARV se estima que se logra entre el 60 y el 90% de los casos, por lo que del 10 al 40% de los pacientes requerirá en un momento determinado de un cambio de esquema. En la mayoría de los estudios clínicos realizados, basados en combinaciones terapéuticas efectivas, los pacientes muestran supresión de la replicación viral por 3 a 7 años.
Existen dos grandes situaciones en las cuales puede plantearse la necesidad de cambiar el TARV
- CAMBIO DEBIDO A EFECTOS ADVERSOS (EAs) O INTOLERANCIA, en ausencia de falla virológica (FV), inmunológica (FI) o clínica (FC), es decir, con CVP indetectable. En este caso puede hacerse la sustitución selectiva del ARV implicado.
- CAMBIO POR FRACASO TERAPÉUTICO, la falla al TARV implica una respuesta subóptima a la terapia; la cual puede ser debida a FV, falla inmunológica (FI) o falla clínica (FC).
En estos momentos existe una preferencia a utilizar pautas sencillas y con menor toxicidad que combinan ITRN no timidínicos con ITRNN o IP/r. Sucesivos fracasos terapéuticos con acumulación de mutaciones de resistencias frente a diferentes familias de ARVs generan oportunidades reducidas de éxito del TARV con mayor incidencia de Sida y muerte.
Los factores que influyen en el fracaso del TARV pueden clasificarse en 3 grupos según dependan del paciente, de los ARVs o del virus.
Entre los factores que dependen del paciente, el más importante es la adherencia al tratamiento que es el mejor predictor de respuesta terapéutica. Si se detecta un fracaso virológico sin mutaciones de resistencia debe evaluarse la falta de adherencia como causa más probable.
Entre los factores que dependen del medicamento, se considera en primer lugar la potencia del esquema terapéutico, los niveles reducidos en sangre por mal absorción o interacciones medicamentosas. Influyen también los errores de dosificación o en la indicación médica.
Entre los factores que dependen del VIH, el más importante es la resistencia a los ARVs que resulta de la interacción de la capacidad replicativa y la presión del ARV.
De las tres fallas, es la falla virológica la más importante, el médico tratante sabrá sospecharla, solicitar los exámenes correspondientes, hacer los cambios empíricos pertinentes, solicitar Test de Resistencia si es indicación, así como tomar todas las medidas necesarias para estos casos. Siempre la evaluación individualizada de los casos será primordial; así como establecer si existe una adherencia adecuada o inadecuada.
La ADHERENCIA ARV se define como: “El cumplimiento del tratamiento que indica el médico, así como la buena disposición del paciente para iniciar el TARV y continuarlo, y su capacidad para tomarlo según las indicaciones recibidas”. Esto hace a los pacientes socios activos de los médicos y responsables del impacto positivo y éxito del TARV.
Por lo tanto, la adherencia incorrecta no es solamente el porcentaje de dosis de medicación no tomadas. La adherencia a corto y a largo plazo es el resultado de un proceso complejo que se desarrolla a través de diferentes etapas: La aceptación del diagnóstico, la percepción de la necesidad de cumplir con el tratamiento de la forma correcta, la motivación para hacerlo, la disposición y capacitación para desarrollar las habilidades necesarias, la capacidad de superar las barreras o dificultades que se presenten, y el mantenimiento de los logros alcanzados con el paso del tiempo.
La adherencia a los ARVs tiene implicaciones a cuatro niveles: Nivel Individual, porque la disminución de una adecuada adherencia limita marcadamente los beneficios terapéuticos y favorece la aparición de resistencias en cada caso tratado; nivel de la comunidad, ya que los virus resistentes pueden transmitirse por todas las vías de contagio de la infección; nivel de servicios de salud ya que la pérdida de adherencia conlleva la necesidad de tratamientos más complejos y por lo tanto equipos de atención mucho más especializados, así como el riesgo aumentado de falla de TARV con incremento de morbilidad y mortalidad así como la demanda de servicios, y a nivel económico, pues el empleo inadecuado de los ARVs conlleva a un gasto claramente ineficiente.
Múltiples son los factores que influyen o determinan la Adherencia ARV: Factores dependientes del paciente (factores de carácter psicológico o trastornos mentales como la ansiedad, la depresión y el estrés; adicción activa a sustancias ilícitas y/o al alcohol, tener o no domicilio fijo y soporte social así como apoyo o influencia de la familia, la pareja o los amigos), factores relacionados con el VIH (estadio CDC de la enfermedad, CD4, Carga viral, resistencia transmitida), factores relacionados al TARV (la interferencia del TARV con los hábitos, bien en el horario de trabajo o en sus actividades habituales diarias, la complejidad del tratamiento, los requerimientos dietéticos, efectos adversos, alteraciones morfológicas), factores relacionados con el médico y el sistema de salud (el suministro de una información detallada, toma de decisiones conjuntas en un marco de confianza y respeto mutuo, la experiencia del médico en VIH/SIDA y en la administración del TARV, así como el tipo de establecimiento sanitario, la accesibilidad al centro de salud y al sitio de dispensación y/o distribución del TARV).
Conclusiones
El desarrollo de los medicamentos antirretrovirales (ARVs) es uno de los mayores logros de la medicina moderna porque han venido a cambiar la realidad en la infección por el Virus de la Inmunodeficiencia Humana (VIH), considerándose ahora una enfermedad crónica y permitiendo una menor morbimortalidad con una mayor sobrevida.
El tener disponibilidad de los ARVs no es garantía de éxito del tratamiento antirretroviral (TARV). Es importante entonces, el entender el papel fundamental que todo el personal de salud, amigos, familiares y ONGs, AI como el paciente, cumplen o deben cumplir en este sentido.
Son muchos los esfuerzos que se vienen realizando en el mundo en esta materia, con el fin de ir logrando un mayor acceso al TARV para un número creciente de personas infectadas. En Venezuela, a través del Programa Nacional de SIDA/ITS (PNSIDA/ITS) del MPPS entre muchas de sus funciones, se planifica y coordina la adquisición y distribución gratuita de ARVs con criterio de universalidad y equidad para toda persona infectada con el VIH que amerite TARV y sea indicado por su médico tratante.
Referencias
- French MA, Price P, Stone SF (2004). Immune restoration disease after antiretroviral therapy. AIDS;18:1615-1627.
- Hirsch H, Kaufmann G, Sendi P, Battegay M (2004). Immune reconstitution in HIV-infected patients. Clin Infect Dis;38:1159-1166.
- Jaime Robertson, Matthew Meier, Jennifer Wall, Jun Ying, Carl J (2006). Immune Reconstitution Syndrome in HIV: Validating a Case Definition and Identifying Clinical Predictors in Persons Initiating Antiretroviral Therapy. Clin Infect Dis; 42:1639–46.
- Atul K. Patel, Ketan K. Patel, Shalin D. Shah and Joy Desai (2006). Immune reconstitution syndrome presenting with cerebral varicella zoster vasculitis in HIV-1-Infected Patient: A Case Report. J Int Assoc Physicians AIDS Care (Chic Ill); 5; 157.
- Panel on antiretroviral guidelines for adult and adolescents (2011). guidelines for the use of antiretroviral agents in hiv-1-infected adults and adolescents. Department of health and human services: 1-128.
- Recomendaciones de Gesida/plan nacional sobre el Sida respecto al tratamiento antirretroviral en adultos infectados por el virus de la inmunodeficiencia humana (actualización 2010), panel de expertos de gesida y plan nacional sobre el Sida, España. Guía practica del SIDA clínica, diagnóstico y tratamiento, Gatell J.M., Clotel B., Podzamczero D., Miro J.M., Mallolas J., 8va. Edición Remsada 2005.
- Documento de consenso del PNSIDA/ITS sobre el tratamiento antirretroviral de las personas que viven con el VIH/Sida en Venezuela, 4ta edición, Ministerio del Poder Popular para la Salud. Programa nacional de Sida/ITS (2010-2012).
- Reglamentación técnica para mejorar la adherencia al tratamiento antirretroviral en Venezuela. Caracas.