Enfermedad por arañazo de gato ¿Porque solo Jalisco reporta la mayoría de los casos? Parte 2
Resumen
La enfermedad por arañazo de gato en México es poco diagnosticada, esta segunda parte versa sobre los métodos paraclínicos complementarios de apoyo a su diagnóstico y las patologías diferenciales especialmente en etiología de de las adenopatias. Se complementa con el tratamiento actual de la enfermedad considerando a la azitromicina con el fármaco de elección. Se revisa su pronóstico y las medidas de atención primaria de prevención que incluye principalmente para los que tienen como mascotas a félinos reciban un manejo integral que incluya manejo de las pulgas que son las que infectan a este de bartonelosis, y que los niños sean educados en el sentido de respetar a sus mascotas no considerando a estas como juguetes o regalos, y el evitar en ellos el contacto con gatos callejeros.
Palabras clave: Adenopatias, enfermedad por arañazo de gato, paraclínicos, tratamiento, prevención.
Fisiopatología
El sello clínico es la linfadenopatía en el lugar de la inoculación. En el huésped inmunocompetente, se produce una respuesta granulomatosa. El huésped inmunodeprimido puede desarrollar una respuesta vascular proliferativa. Los ganglios linfáticos afectados se agrandan y se vuelven sensibles durante una o dos semanas. La enfermedad por arañazo de gato también es una causa común de linfadenopatía crónica que puede extenderse más allá del sitio de inoculación. La enfermedad por arañazo de gato puede diseminarse a los ojos, el hígado, el bazo y el sistema nervioso central (SNC).1
Histología
No es recomendable ni el corte ni el drenaje, ni la extirpación quirúrgica de los ganglios ya que esto condicionara la formación de fístulas. Sin embargo si se cuenta con muestra de tejido por punción con aguja fina del ganglio linfático disponible, ocasionalmente se pueden visualizar los bacilos utilizando una tinción argéntica de Wartin-Starry no obstante esta no es especifica para B henselae y su negatividad no excluye la enfermedad. En ella los cambios histológicos incipientes en los fragmentos de ganglios consisten en infiltración linfocítica con formación de un granuloma epitelioide. que terminan por mostrar necrosis, sin embargo se asemejan a las de los sujetos con tularemia, brucelosis e infecciones por micobacterias. Por tanto esta descripción histológica por si sola no es diagnóstica de la enfermedad, ni tampoco su negatividad la descarta.
En casos extremadamente raros, la detección por PCR de fragmentos de ADN específicos de la biopsia de ganglios linfáticos proporciona una detección sensible de la enfermedad. La técnica debe considerarse para pacientes con sospecha de CSD y aerología negativa, ya que los ensayos serológicos exhiben baja sensibilidad. En casos ambiguos, la exploración quirúrgica puede proporcionar tejido para el diagnóstico; Es bien tolerado y permite una recuperación mejorada. 2,3
Radiología
Un estudio realizado por Erdem et. Al en 13 niños con infección ósea por EAG ingresados en un gran hospital de niños de atención terciaria durante un período de 12 años. La mediana de edad fue de 7 años y la mediana del tiempo desde el inicio de la enfermedad hasta el diagnóstico fue de 10 días. La osteomielitis multifocal que afecta la columna vertebral y la pelvis fue común; ningún paciente tuvo una lesión ósea lítica. La mediana de la duración del tratamiento fue de 28 días (RIC, 24,5 días). A pesar de las variaciones significativas en la duración del tratamiento y las opciones de terapia antimicrobiana, todos los pacientes mostraron mejoría. 4 Las radiografías simples en cuello o en sitios afectados nos dan una idea de la localización y la radio luminosidad de los ganglios así como una idea de adherencia, se complementa esta con Tomografía Axial Computada. (TAC)
Ultrasonido
En el abordaje de un niño con fiebre prolongada, el ultrasonido de hígado y bazo o bien una topografía axial computada tiene gran rendimiento de sospecha diagnóstica, en estos se pueden documentar en el hígado y bazo imágenes hipoecoicas que corresponden a microabscesos múltiples Un estudio de Bances y cols 5 en 44 casos de EAG en niños. El cuadro clínico más frecuente fue la fiebre (95,45%) y linfadenopatías (36,08%). El 75% presentaron abscesos. Microesplénicos 34% y microabscesos hepatoesplénicos 29,5%. Los hallazgos ecográficos de lesión hepática se encontraron en 36,4%, la media del tamaño de los nódulos fue 8,94 ± 4,17 mm, hipoecoicas en el 93,8% y una ecogénica. La lesión esplénica estuvo presente en el 72,7%, la media del tamaño de los nódulos fue de 8,31 ± 3,92 mm, hipoecoica y una isoecoica. Según este estudio el mayor compromiso es esplénico según hallazgos ecográficos, así como no hubo compromiso hepatoesplénico en 10 pacientes, lo cual es un hallazgo habitual en otros reportes sobre todo en pacientes con infección por VIH. 6
En casos mortales por EAG se han documentado múltiples lesiones hepáticas, esto siempre justifica estudiar exhaustivamente a niños con fiebre prolongada en los cuales no se cuente con un diagnóstico y el cual debe de incluir ultrasonido en manos experimentadas buscando intencionadamente microabscesos en hígado y bazo o bien realizar Doppler Color buscando microabscesos. 7
Es muy importante el antecedente epidemiológico de lesión por felino y un cuadro clínico de linfadenopatía que no requerirá necesariamente tengamos la serología positiva, algunos autores indican tratamiento inmediato. Sin embargo es importante mencionar que para el diagnóstico se pueden utiliza los criterios de Margileth:
- Noción de contacto con gato;
- Serología negativa para otras causas de adenopatía, aspirado estéril de adenopatía, y/o lesiones hepáticas/ esplénicas;
- Serología positiva para B. henselae
- Biopsia ganglionar con inflamación granulomatosa o tinción de Warthin-Starry positiva.
Se considera caso confirmado cuando se cumplen 3 criterios. Se considera caso probable cuando se cumplen los criterios 1 y 2 de Margileth. 8
En pacientes inmunocompetentes con endocarditis sin etiología demostrada siempre habrá de pensar en EAG, la mayoría presentan fiebre de origen desconocido y dolor abdominal. 9
Diagnóstico diferencial
1. De las adenopatías
La principal enfermedad que siempre habrá de descartar en nuestro medio es la linfadenitis cervical por micobacterias no tuberculosas, siempre será necesario en todos los casos contar con una radiografía simple de Tórax la cual puede mostrar micronodulaciones y reacción del complejo de Ghon lo cual nos haría sospechar tuberculosis extraganglionar. La realización de un PPD, reacción de la cadena de la polimerasa específica, Baar en expectoración y en jugo gástrico en serie de 3 siempre será parte del abordaje.
Aun cuando las linfadenitis por micobacterias no tuberculosas (NTM) es una enfermedad rara en niños menores de 5 años habrá de considerar siempre a Mycobacterium avium y M. intracellulare 10
Las biopsias con aguja fina pudieran estar indicadas ante la duda diagnóstica. Las adenopatias por EAG mostrarán generalmente datos de inflamación (edema, rubor, calor, dolor) lo que no ocurre en la gran mayoría de los casos cuando se trata de llinfadenitis tuberculosas. 11
Otro dato importante es que esta linfadenitis tiene una respuesta al tratamiento muy tardía lo cual hará un diagnóstico más preciso, no así la EAG que tiene un pronta respuesta al tratamiento antimicrobiano. Otras afecciones por abscesos de etiología estafilococcica habrán de ser consideradas en el diferencial. Otra entidades serán los linfomas, pero también habrá de realizar serología para Toxoplasma, Ebstein Barr, Citomegalovirus y Tularemia.
La identificación de la linfadenopatia cervical es básicamente clínico y se concentra en evaluar la situación geográfica y edad del paciente, en una historia clínica completa, con énfasis en lesiones dentales y en piel, exposición a mascotas (como en estos casos en donde este antecedente fue positivo) o insectos, viajes, duración de la enfermedad, otras manifestaciones clínicas asociadas serán también consideradas, contactos con personas enfermas, exposición a fármacos, alimentos ingeridos (leche no pasteurizada o carne mal cocinada).
El diagnóstico diferencial tratándose de masas en el cuello se debe realizar con otras causas de estas como son: quiste tirogloso, quiste braquial, higroma quístico, neoplasias tiroides o infiltrativas, enfermedades por atesoramiento, quiste epidermoide, lipomas entre otros. 12
De las infecciones a sistema nervioso central con pobre respuesta a la terapia empírica y sin aislamiento de germen ni positividad para panel de sospecha, siempre habrá de descartar EAG. 13 En infecciones de etiología inexplicable y manifestaciones mínimas. los diagnósticos deben incluir siempre pruebas para detectar Bartonella henselae. 14
Dentro de las causas de FP, las de origen infeccioso siguen predominando, sin embargo, como parte del manejo integral todos los niños con FP deben ser abordados por grupos de edad, debido a que pacientes menores de dos años edad el origen infeccioso suele ser la causa más común, y a mayor edad se deben considerar otras posibles causas. 15 En un estudio chileno, estudiaron 153 niños, donde 104 (88.4%) fue por causa infecciosa, neoplásica y reumatológica en un 4.8% y un 2.8% correspondió a enfermedad de Kawasaki. 16
Tratamiento
El abordaje terapéutico de la infección por Bartonella varía en función de las manifestaciones clínicas y el estado inmunológico del paciente.
Existe una división significativa en la literatura entre la eficacia in vitro e in vivo de los antibióticos. In vitro, se ha descubierto que las especies de Bartonella son sensibles a varios agentes antimicrobianos como macrólidos, aminoglucósidos, B-lactámicos, cefalosporinas de tercera generación, trimetoprim-sulfametoxazol, rifampicina y ciprofloxacina. Sin embargo, este amplio espectro de actividad no se confirmó en la práctica clínica. In vitro, la mayoría de los antibióticos probados tenían actividad bacteriostática contra Bartonella; sólo los aminoglucósidos demostraron actividad bactericida. La débil penetración en la membrana celular de muchos antibióticos y su actividad bacteriostática son las principales hipótesis de por qué estos fármacos no llegan a la Bartonella sp. Intracelular.
Debido a la historia natural de la EAG sin complicaciones, no se recomiendan antibióticos para la EAG regional. Para las infecciones leves a moderadas en pacientes inmunocompetentes, el tratamiento consiste en tranquilizar, un seguimiento adecuado y analgésicos para el dolor. Los ganglios deben aspirarse si supuran para aliviar la adenopatía dolorosa; sin embargo, no se recomienda la incisión ni el drenaje debido a la posibilidad de formación crónica del tracto sinusal. Durante la aspiración, la aguja debe moverse alrededor de varios lugares diferentes, ya que los microabscesos fusionados a menudo existen en múltiples bolsas septadas. 16
1. De la enfermedad localizada
Si se trata de enfermedad localizada no complicada el tratamiento es sintomático debido a que la enfermedad suele ser autolimitada y se resuelve espontáneamente en un plazo máximo de 2 a 4 semanas. Aunque hay estudios que muestran que es mejor iniciar tratamiento por 5 días de azItromicina y evitar en lo posible las complicaciones que son muchas y algunas sumamente difíciles de diagnosticar cuando con el tiempo no se cuanta con el antecedente de arañazo, mordedura y lamedura de un gato. La azitromicina es el fármaco de elección en el paciente inmunocompetente, esta ha demostrado tener un beneficio clínico moderado en el tratamiento de enfermedad localizada, con una disminución significativamente superior del volumen de los ganglios linfáticos luego de 1 mes sin embargo no ha mostrado mejoría sintomática. La dosis indicada esa de 10 mgs kg día, el primer día y 5 mgs. kg día del 2o. al 5o. vía.oral 17 Las personas con un peso mayor o igual a 45 kg pueden recibir la dosis para adultos (máxima) de 500 mg día uno y 250 mg de día 2 a 5. Las otras alternativas de manejo son rifampicina, trimetoprim-sulfisoxazol y ciprofloxacina para la enfermedad diseminada grave sobre todo en paciente inmunodeficientes. 1
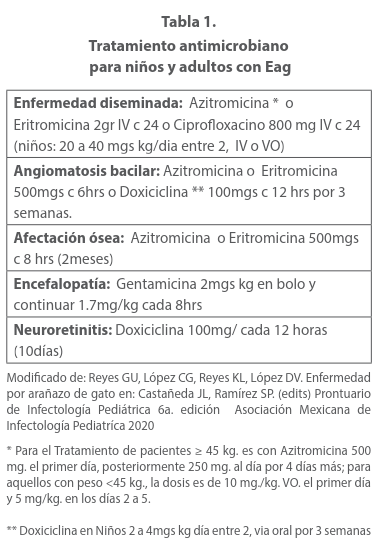
En la gran mayoría de los casos deberá de evitarse la incisión y el drenaje, porque esto podría facilitar la formación de fístulas y la extirpación quirúrgica en general es innecesaria. Se recomienda tratamiento antimicrobiano en enfermedad sistémica en pacientes inmunocompetentes y en todos los pacientes inmunocomprometidos.
2. De la enfermedad invasiva
Algunos agentes eficaces son los antimicrobianos orales (claritromicina, ciprofloxacina, doxicilina, trimetoprim- sulfametoxazol, rifampicina) y gentamicina parenteral. Están indicadas en el paciente que muestren ataque a hígado y bazo u otros otros órganos, como sistema nervioso central. El tiempo de manejo se pueden resumir en 6 a 8 semanas o incluso mas tiempo en pacientes inmunocomprometidos 19. La claritromicina esta indicada sobre todo en pacientes complicados con osteomielitis u otras afecciones de órganos. Estudios realizados comparando la efectividad de Azitromicina Vs. TrImetropin-sulfametoxazol no mostraron diferencias significativas, (51.4% versus 61.5% de efectividad respectivamente), por tanto el uso de Trimetropin sulfametoxazol es un buena alternativa en tratamiento de segunda línea.20 Algunos autores recomiendan asociar rifampicina mas doxiciclina en niños mayores de 8 años, en menores de esta edad rifampicina mas azitromicina. En estos últimos la sustitución de doxiciclina por un macrólido es porque las tetraciclinas puede causar decoloración dental permanente. La neurorretinitis se suele tratar con antibióticos sistémicos y corticosteroides para reducir la inflamación del disco óptico y promover un retorno más rápido de la visión, en estos casos se prefi ere la doxicicilina. La azitromicina o la doxicilina son eficaces en el tratamiento de angiomatosis bacilar y peliosis bacilar; la terapia debe administrarse durante varios meses para prevenir recaídas en personas inmunocomprometidas. En los pacientes con fiebre prolongada y compromiso hepatoesplénico se pueden utilizar esteroides (prednisona) esto es para acortar el periodo febril, aunado al tratamiento específico. 21 Pero también tiene indicaciones en la neurorretinitis esta se suele tratar con antibióticos sistémicos y corticosteroides para reducir la inflamación del disco óptico y promover un retorno más rápido de la visión, en estos casos se prefiere la doxiciclina. En menores de 8 años se podría usar un macrólido debido a que las tetraciclinas pueden causar decoloración dental permanente. Aunque la doxiciclina no origina esta reacción secundaria. La endocarditis infecciosa asociada con abscesos hepatoesplénicos son manifestaciones raras de la enfermedad por EAG. El tratamiento prolongado con doxiciclina y gentamicina conduce a la recuperación completa. 22 Si la valoración oftalmológica muestra granulomas en la cabeza del nervio óptico y de la retina se recomienda la asociación de doxiciclina 100 más cada 24 hrs mas rifampicina que pude ser 300mgs cada 12 hrs o 600mgs c 24hrs. Entre 3 a 7 semanas de acuerdo a la evolución de los casos. 23
Importancia de la EAG en Salud Pública
Se han detectado secuencias de ADN que coinciden con Bartonella coopersplainsensis y B. henselae en muestras de 22/143 (15,4%) y 3/143 (2,1%) ratas, respectivamente. Co-ocurrencia de B. coopersplainsensis y B. henselae esta secuencia se observó en la muestra de una rata. Los roedores desempeñan un papel importante como repertorios de una amplia gama de especies de Bartonella. Hasta donde sabemos este es el primer informe de una detección molecular de Bartonella spp. ADN en roedores de Nueva Zelanda, y la primera identificación del ADN de B. henselae en ratas, en todo el mundo. Si bien la importancia de B. coopersplainsensis para la salud pública sigue sin definirse. B. henselae es el agente de la enfermedad por arañazo de gato y la presencia de esta bacteria en ratas puede tener implicaciones para la salud pública.24 Actualmente, Breitschwerdt y otros investigadores están colaborando con el Duke University Medical Center, con médicos de la UNC Chapel Hill, con investigadores de Brasil y con algunos investigadores de Alemania, sobre muchas enfermedades crónicas relacionadas con EAG La bacteria Bartonella vinsonii subespecie berkhoffii y la bacteria Bartonella henselae, generalmente pueden ser transferidas a los bebés humanos a través de la madre, lo cual aumenta el riesgo de infección crónica y defectos de nacimiento provocados por bacterias, según un estudio publicado en junio de 2010 en Journal of Clinical Microbiology. 25

Pronóstico
Los resultados para los pacientes inmunocompetentes con EAG son excelentes. sin embargo, aquellos que tienen afectación del sistema nervioso central o periférico pueden desarrollar algún tipo de déficit neurológico que puede persistir después del tratamiento. La muerte en pacientes inmunocompetentes es rara. La linfadenitis suele tardar varios meses en resolverse, pero la mayoría de los pacientes desarrollan una inmunidad permanente a la infección. El pronóstico en pacientes inmunocomprometidos es reservado y está relacionado al diagnóstico temprano y a la enfermedad de base 26, 27 sobre todo en los pacientes con enfermedad diseminada pueden tener un espectro de complicaciones, especialmente en los huéspedes muy jóvenes, ancianos e inmunocomprometidos, como el trasplante o el paciente con VIH.
Prevención
Primaria: Una buena parte de las infecciones pudieran evitarse simplemente que los dueños de los gatos en cautiverio los mantuvieran sin pulgas y un manejo adecuado de sus excretas y limpieza de su hábitat. Esta en fase experimental una vacuna para la protección de los gatos. En cuanto a los gatos callejeros, se requieren políticas de salud pública para su control. Los perros y gatos son vistos como un regalo estético, una vez que crecen, la persona tiende a retractarse del compromiso que implica cuidarlos, obviando que cuidar una mascota implica adquirir una responsabilidad, las campañas de esterilización son un camino correcto de control. Los niños inmunocomprometidos, con enfermedades anergizantes o crónicas que estén recibiendo esteroides o inmunosupresores, NO deberán de tener contacto con mascotas sobre todo gatos. Ante una lamedura, arañazo o mordedura de gato, deberá en forma inmediata realizarse lavado enérgico del sitio lesionado o expuesto, este se hará con agua y jabón o bien con algún antiséptico o ambos. Esta es la mejor manera de evitar que se inocule el germen.
Secundaria: Diagnóstico temprano de los casos, considerando siempre ante un niño con linfadenopatia regional con datos de inflamación la posibilidad de EAG. aplicación de calor y la administración de analgésicos. 28-30
El manejo temprano de los casos con Azitromicina evitará complicaciones graves en lo subsecuente.29 Ante un niño en estudio con fiebre prolongada aun cuando no se tenga el antecedente de convivencia con un gato, siempre considerar la posibilidad de esta enfermedad. 31, 32
Referencias bibliográficas
- Nelson CA, Moore AR, Perea AE, Mead PS. Enfermedad por arañazo de gato: experiencia y conocimiento de los médicos de EE. UU. Zoonosis Salud Pública. 2018 Feb; 65 (1): 67-73. [ PubMed ]
- Chondrogiannis K, Vezakis A, Derpapas M, Melemeni A, Fragulidis G. Seronegative cat-scratch disease diagnosed by PCR detection of Bartonella henselae DNA in lymph node samples. Brazilian Journal of Infectious Diseases 2012; 16(1):
- Donovan TA, Balakrishnan N, Carvalho BI, McCoy T, Breitschwerdt EB, Foax PR. Bartonella spp. as a Possible Cause or Cofactor of Feline Endomyocarditis-Left Ventricular Endocardial J Comp Pathol. 2018;162: 29-42.
- Erdem G, Watson RJ, Garret HW, Young C, Tomatis SC, Jonathan R. et. al. Clinical and radiologic manifestations of bone infection in children with cat scratch disease J Pediatr 2018; 20(1): 274-80
- Bances GM, Landa GL, Amoreti M, Candela HJ. Detección ecográfica de lesiones hepatoesplenicas en niños con Enfermedad por arañazo de gato. Rev Peruana Radiol 2011; 15(1): 32-6
- Inmaculada P, Sanfeliu I, Nogueras MM, Sala M, Cervantes M, Amengual J, Segura F. Seroprevalence of Bartonella spp infection in HIV patients in Catalonia Spain BMC Infect Dis. 2008; 8: 58.
- Baptista M, Lo D, Hein N, Hires M, Miyao C, Betta S et al. Cat- scratch disease presenting as multiple hepatic lesions: case report and literature review. Autopsy Case Report. 2014; 4(2): 43-48.
- Olasoal MC, García GM, García GG, Giachetto LM, Gutierrez B, Pirez G. Enfermedad por arañazo de gato: características clínicas en niños hospitalizados Cat scratch disease: Clinical characteristics in hospitalized children. Anales de Pediatría 2011; 74(1): 42-6
- Shasha D, Gilon D, Vermea F, Moses EA, Strhilevitz J. Visceral Cat Scratch Disease With Endocarditis in an Immunocompetent Adult: A Case Report and Review of the Literatur Vector Borne Zoonotic Di 2014; 14(3): 175-81. doi: 10.1089/ vbz.2012.1279. Epub 2014 Feb 27.
- Gallois Y, Cogo H, Debuisson C, Guet-Revillet H, Brehin C, Baladi B. Et al.Nontuberculous lymphadenitis in children: What management strategy? Int J Pediatr Otorhinolaryngol. 2019; 122: 196-202.
- Cedeño CH, Sánchez DM, Salcedo VI, Mena CC. Reporte de caso clínico: enfermedad por arañazo de gato en paciente Pediátrico. Rev. Med. FCM-UCSG, 2014; 18(4): 71-4
- Reyes CA. Linfadenopatía Cervical, Criterios clínicos. Acta Pediatr Mex. 2017; 38(3): 208-14
- Barnafi N, Conca N, Von Borries C, Fuentes I, Montoya F, Alcalde E. Infección por Bartonella henselae con compromiso de sistema nervioso central, asociado a un papiloma del plexo coroídeo Rev Chilena Infecto 2017; 34 (4): 383-8
- Karski J, Matuszewski L, Okonski M, Pietrzyk D, Karska K. Cat Scratch Disease in a 1.5-year-old girl – Case report. Ann Agric Environ Med. 2018; 25(2): 345-8.
- Matias SF, Xochihua DL, Reyes HK, Reyes GU, Miranda GD, Guerrero BM y cols. Abordaje del niño con fiebre prolongada. Bol Clin Hosp Inf Edo Son 2020; 37(1): 15-22
- Somoza MM. Fiebre prolongada y fiebre de origen desconocido, Act Pediat Aten Prim. 2012; 5(3): 144-8.
- Prutsky G, Domecq JP, Mori L, BBC S, Matzumura M, Sabouni A, Shahrour A, Erwin PJ, Boyce TG, Montori VM, Malaga G, Murad MH. Treatment outcomes of human bartonellosis: a systematic review and meta-analysis. Int. J. Infect. Dis. 2013; 17(10): 811-9.
- Gallagher CJ, MacCougall C. Antibiotics simplified fourth edition University of Callifornia USA: Jones Bartlett Learning; 2018.p.106-8.
- Pennisi MG, Marsilio F, Hartmann K, Lloret A, Addie D, Belák S. Et. Al Bartonella species infection in cats: ABCD guidelines on prevention and management. J. Feline Med. Surg. 2013;15(7): 563-9.
- Shorbatli LA, Korany KI, Nahata MC. Effectiveness of antibiotic therapy in pediatric patients with cat scratch disease. Int J Clin Pharm. 2018; 40(6):1458-61
- Phan A, Castagnini L. Corticosteroid treatment for prolonged fever in hepatosplenic cat-scratch disease: a case study. Clinical Pediatrics. 2017; 56(14):1291-2
- Maiques TE, Tomates SC, Watson J, Ramilo O, Media A. Enfermedad diseminada por arañazo de gato: en amplio espectro de la presentación Anales de Pediatría 2019; 90(6): 393-5
- Florin TA, Zaoutis TE, Zaoutis LB. Beyond cat scratch disease: Widening spectrum of Bartonella henselae infection. Pediatrics 2008; 121: 1413-25
- Helan JVG, Grinberg A, Gedye K, Potter MA, Harrus S. Molecular detection of Bartonella coopersplainsensis and B. henselae in rats from New Zealand. N Z Vet J. 2018; 66(5): 257-60
- Vierira DG, Paolo VP, Urso LH, Sowy S,Gerardi SD, Grosselli B. Et al. Bartonella clarridgeiae Bacteremia Detected in an Asymptomatic Blood Donor Journal of Clinical Micrbiology 2010; 43: 2651–5.
- Barros S, de Andrade GC, Cavalcanti C, Nascimento H. Cat Scratch Disease: Not a Benign Condition. Ocul. Immunol. Inflamm. 2018;26(7):1115-22.
- Prutsky G, Domecq JP, Mori L, Bebko S, Matzumura M, Sabouni A. Et al. Treatment outcomes of human bartonellosis: a systematic review and meta-analysis. Int. J. Infect. Dis. 2013; 17(10): 811-9.
- Bush ML, Pérez TM. Last full review/revision 2018
- Bass JW, Freitas BC, Freitas AD, Sisler CL, et al. Prospective randomized double blind placebo-controlled evaluation of azithromycin for treatment of cat-scratch disease. Pediatric Infect Dis J 1998; 17: 447-5
- Ives TJ, Manzewitsch P, Regnery RL, et al. In vitro suscepti- bilities of Bartonella henselae, B. quintana, B. elizabethae, Rickettsia rickettsii, R. conorii, R. akari and R. prowazekii to macrolide antibiotics as determined by immunofluorescent antibody analysis of infected vero cell monolayers. Antimi- crob Agents Chemother 1997; 41: 578-82.
- Rolain JM, Brouqui P, Koehler JE, et al. Recommendations for treatment of human infections caused by Bartonella species. Antimicrob Agents Chemother 2004; 48: 1921-33.
- Margileth AM. Recent advances in diagnosis and treatment of cat scratch disease. Curr Infect Dis Rep 2000; 2: 141-6.
Martinez-Arce P.(1), Reyes-Gómez U.(2)(3), Aquino-Villagómez D.N.(2), Reyes-Hernández K.L.(4), Reyes-Hernández M.U.(3), Espinosa-Sotero C.(5), Hernández-Magaña R.(2), Sánchez-Navarro L.M.(3), Echeverria-Mayrén C.(3), Guerrero-Becerra M.(2), Matos-Alviso L.J.(1)(3), Pérez-Pacheco O.(3), Cuevas-López L.L.(3), Reyes-Cruz M.A.(2).
- Departamento de infectología Pediátrica Antiguo Hospital Civil, Guadalajara Jalisco;
- Grupo de Investigación en Infectología Pediátrica GIIP;
- Unidad de Investigación en Pediatría. Instituto San Rafael San Luis Potosi;
- Residente de Neonatologia Instituto Nacional de Perinatologia, México;
- Servicio de infectología Pediátrica Hospital General de México.

