Enfermedad por arañazo de gato: ¿porque solo Jalisco reporta la mayoría de los casos? Parte 1
Resumen
La enfermedad por arañazo de gato representa hasta un 10% de las enfermedades zoonoticas, es trasmitida al humano por un gato infectado con bartonella hanselae a través de un arañazo, mordedura o lamedura. El cuadro clínico inicial es de alta sospecha y caracteriza por datos de inflamación local seguido de una adenopatia regional. La importancia de esta revisión es que aun cuando muchos casos en su historia natural se limitan, un 10% pueden progresar a una enfermedad sistémica con síntomas multivariados que harán difícil el diagnóstico, sobre todo en huéspedes inmunocomprometidos. México tiene reportes mínimos sobre esta enfermedad, por ello habrá de considerar esta etiología ante un niño con fiebre sin causa aparente, adenopatía regional con datos de inflamación y aunque no siempre se considera esta, habrá de pensar en ella. En esta primera parte revisamos datos epidemiológicos clínicos y de laboratorio.
Palabras clave: Bartonella Hanselae, cuadro clínico, enfermedad por arañazo de gato, epidemiología, exámenes de laboratorio.
Introducción
La enfermedad por arañazo de gato (EAG) representa de 2-10% de las enfermedades zoonóticas, es una enfermedad evidenciada en niños en contacto con gatos infectados con una seroprevalencia de entre 13 y 90% entre gatos domésticos y callejeros en los Estados Unidos. Un estudio realizado por los seguros de salud nacionales mostró una incidencia más alta de casos en los que vivían al sur (6.4 % de casos por 100 mil habitantes). Se calcula que por cada 5.4 habitantes en una región, existe un gato. 1, 2.
En México no contamos con cifras de esta enfermedad dado que los reportes son escasos y solo se documenta una sola serie de casos, lo cual nos habla de un subregistro, de las series conocidas solo existe una del servicio de infectología Pediátrica del Antiguo Hospital Civil de Guadalajara y otros reportes esporádicos de casos únicos fortuitos. 3
Las mordeduras y arañazos originadas por gatos siguen en frecuencia a las producidas por los perros, representan entre un 3 a un 5 % de todas las mordeduras, 90% de los casos ocurre sobre los mismos dueños, esta es producidas por los dientes largos y agudos de los félidos la cual penetra fácilmente la piel, originado no solo EAG sino infecciones hasta en un 50 % lo cual se considera una cifra muy alta. La mayoría de las lesiones se localizan en el brazo, antebrazo, manos y en pocos casos en la cara, y en forma ocasional en piernas. Bartonella Hanselae se ha aislado de su pulpa dental y de su sangre.
La transmisión de enfermedades de los animales a los seres humanos tiene interés especial en la atención de los niños, pues ellos interactúan con mascotas, roedores indeseables y otros animales.4 Por tanto esta patología queda clasificada como una zoonosis, que tiene una parte preventiva importante. Existen por lo menos una decena de enfermedades totalmente reconocidas que el gato transmite al humano entre estas: Leptospirosis, Toxocariosis, Toxoplasmosis, Sarcoptess Scabiei, micosis principalmente esporotricosis, Rabia, enfermedad de Lyme, Campilobacteriosis, Francisella tularensis, síndrome de larva migran visceral, Angilostomiasis, y la Enfermedad por arañazo de gato también conocida como Bartonellosis. 5
La transmisión de un gato a otro ocurre a través de la pulga del gato (Ctenocephalides feliz) con infección felina que resulta en bacteriemia, la cual por lo general es asintomática y dura de semanas a meses. Por tanto, se considera al gato como reservorio y a la pulga como vector. Se han reportado en la literatura casos de EAG relacionados con zoonosis por perros, conejos, hurones y monos entre otros. (Foto 1)
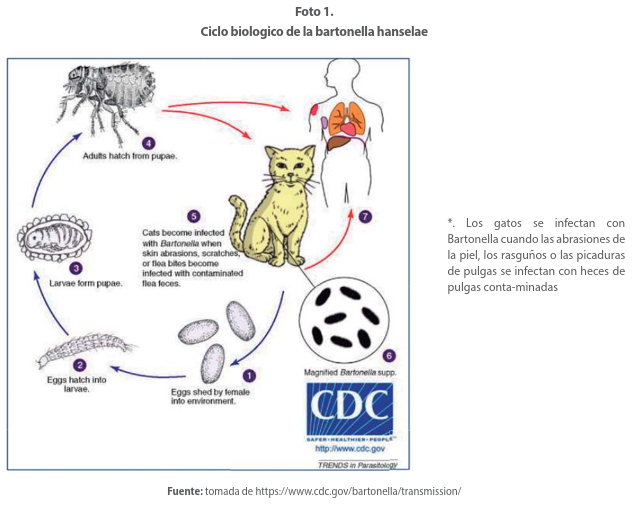
Las bacterias se transmiten a los seres humanos por inoculación a través de un arañazo una lamedura o una mordida de un gato bacterémico o por manos contaminadas con heces de pulga que tocan una herida abierta o un ojo. Los gatitos pequeños (con más frecuencia que los gatos adultos) y los animales provenientes de refugios o adoptados de la calle tienen más probabilidades de ser bacterémicos.
Más de 90% de individuos con la EAG tienen el antecedente de contacto reciente con gatos al parecer sanos, a menudo gatitos pequeños, o de refugios adoptados de la calle tienen más posibilidades de ser bacterémicos, estos son seropositivos en un 75%, entre un 13 a 90 % de los gatos domésticos y callejeros son positivos en USA. Aunque existe una gran variabilidad en este hecho, otros reportes hablan de evidencia de infección en felinos de 15 a 44%. En Singapur 47.5%, en Francia 36%, en Chile 8.56%, Argentina 11.9% 6
En el sitio supuesto de inoculación bacteriana con frecuencia hay una pápula cutánea una a dos semanas antes de que surja la linfadenopatía. Esta última incluye ganglios que reciben drenaje del sitio de la inoculación, típicamente ganglios axilares, pero también puede haber ataque de ganglios cervicales, epitrocleares e inguinales. En forma típica la piel que está sobre los ganglios afectados es dolorosa al tacto, caliente, eritematosa e indurada. En 25 a 30% de personas con EAG los ganglios afectados muestran supuración espontánea. 7
Los niños inmunocompetentes afectados suelen tener un curso auto limitado, pero los pacientes inmunocomprometidos pueden desarrollar una enfermedad sistémica grave después de la infección. 8 La presencia de linfadenopatía regional, aguda, subaguda o crónica con datos localizados de inflamación (rubor, color, dolor) así como la presencia de fiebre prolongada y antecedente de convivencia con gatos, nos debe de hacer sospechar de la presencia de EAG, e incluir en el estudio del paciente la serología o tinciones para esta enfermedad, evitando su cronicidad con un tratamiento adecuado. 9
La EAG fue descrita por primera vez en 1930 y la asociación de la enfermedad con los gatos se identificó en la década de 1950. 10 Otros datos describen que la primera descripción científica de la EAG fue hecha por primera vez en Paris en 1950 por el Dr. R. Debré. Sin embargo, ya en 1889 el Dr. Henri Parinaud había descrito la presentación óculo glandular de esta enfermedad en tres pacientes con linfoadenopatía preauricular. La búsqueda de los agentes infecciosos responsables de la EAG fue bastante complicada. Durante los primeros años se sospechó de distintos agentes, incluyendo al virus herpes y bacterias del género Chlamydia y Pasteurella. En 1983 se aisló un agente bacteriano desde nódulos linfáticos de pacientes con EAG, en 1988 este agente fue caracterizado completamente y se le denominó como Afipia felis. La hipótesis que relacionaba a A. felis como el agente de la EAG fue descartada luego que no se lograran realizar nuevos aislamientos, ni se encontrara respuesta serológica a la bacteria en pacientes con la patología.
En 1990, a través de dos estudios independientes se aisló una nueva bacteria a partir de pacientes inmunodeprimidos con angiomatosis bacilar y de pacientes inmunocomprometidos e inmunocompetentes con fiebre y la bacteria. El material genético obtenido fue amplificado a través de la reacción en cadena de la polimerasa (PCR), y al comparar los resultados con genes secuenciados de otras bacterias se evidenció una estrecha relación con B. Quintana (98.7% de homología).
Esta bacteria se estableció como el agente etiológico primario de la EAG y se denominó B. henselae en honor a Diane Hensel, una microbióloga que contribuyó al aislamiento inicial de la bacteria. 11
En el pasado hubo descripciones clínicas de la EAG durante más de 50 años, pero el agente bacteriológico no se identificó durante décadas. El Dr. Douglas Wear un patólogo, identificó una nueva bacteria en los ganglios linfáticos de pacientes con EAG. Esto llevó a décadas de investigación para identificar el agente bacteriológico. Inicialmente, hubo reactividad cruzada entre las especies de Chlamydia y Bartonella. Después del desarrollo de la microscopía electrónica, se usó la tinción de Warthin Starry para detectar manchas negras de las bacterias en las muestras de ganglios linfáticos afectados. La entidad de angiomatosis bacilar en la era del SIDA identificó la bacteria Warthin-Starry positiva a principios de la década de 1990 y se descubrió que era el mismo agente que un grupo control de pacientes con EAG 12-14
Etiología El agente infeccioso Bartulea Henselae (anteriormente conocida como: ex Rochilimaea henselae) infecta a los gatos por medio de pulgas “ctenocephalides felis”. Es un Bacilo gran negativo, pleomófico, intracelular y de crecimiento lento, B. henselae es difícil de cultivar. 15 Foto 2
Es diseminado por saliva al lamer o morder o por medio de un arañazo, sobre todo a un niño, de ellos los de más riesgo son los varones escolares. Aunque se han reportado casos en niñas inmunocomprometidas, en niños más pequeños, los reportes son ocasionales. Actualmente se está hablando de un género de Bartonella Clarridgeiae que también se sospechara ocasionaba la enfermedad, lo cual se ha descartado 16 Existe dos serotipos/genotipos de B. henselae: el tipo I (Houston I) y el tipo II (BA-TF [angiomatosis bacilar-fiebre de las trincheras]/Marsella). Las especies de Bartonella son bacterias intracelulares capaces de producir varias enfermedades en los seres humanos. Las tres más comunes y conocidas son: La enfermedad por arañazo de gato (EAG) causada por B. henselae en inmunocompetentes y angiomatosis bacteriana en pacientes inmunocomprometidos, la fiebre de las trincheras causada por B. Quintana (transmitida por piojos, y documentada en la primera. guerra mundial) y la enfermedad de Carrión causada por B. bacilliformis.17 La EAG también es conocida también como linforreticulosis.
Epidemiología
En la actualidad la mayoría de los hogares cuenta con una o más mascotas, en Estados Unidos (E.U.) se reporta hasta más de 50% de hogares con alguna mascota, hasta un 65% en poblaciones de Australia y 70% en Chile y por mucho las más comunes son perros y gatos, pero conejos, aves de corral y otros roedores han incrementado de forma significativa, así como una amplia gama de reptiles y otras especies exóticas, las cuales se ven con más frecuencia como animales de compañía principalmente en la infancia. La convivencia con mascotas ha traído consigo un beneficio significativo en los ámbitos tanto social como en la salud mental de sus propietarios.18,19 En los Estados Unidos más de 50% de los hogares posee al menos una mascota, siendo el perro el más común seguido del gato, peces y reptiles, Según una encuesta en Francia se reportó que entre la población encuestada había 44.3 millones de mascotas, de las cuales se encontraron en primer lugar los peces, seguidos de gatos y perros. Los reportes en Latinoamérica hablan de cifras similares. Un estudio realizado en Chile reveló que 70% de los hogares poseen alguna mascota, en el 54% de los casos se trataba de perros, 25% eran gatos, 15% aves, 3% roedores y 3% animales exóticos. En Argentina se reconoce la existencia de un gran número de animales domésticos, principalmente perros, que son vagabundos y semi- vagabundos que no son controlados, constituyen una fuente importante de contaminación al ambiente y por ende un problema de salud pública. 20
En México de acuerdo con el censo 2016 del Instituto Nacional de Estadística y Geografía (INEGI), es el país de la región de América Latina con el mayor número de perros en la región, con aproximadamente 19.5 millones en todo el país. Esto se traduce en que 7 de cada 10 hogares en México cuentan con una mascota. De hecho, el Consejo Nacional de Población (CONAPO) revela que el número de perros domésticos aumentó 20% del año 2000 al 2010; mientras que, alrededor del 80% de los habitantes con mascotas tiene caninos en su hogar. Del total de perros en el país, INEGI 21 reveló que sólo 5.4 millones tienen hogar. Está realidad pone en evidencia la necesidad de que las personas que adoptan un perro se responsabilicen de ellos, pues una de las principales razones del abandono animal está relacionada con factores económicos.
En cuanto a félidos no se cuentan con cifras sin embargo un 70% de los perros y gatos se encuentran abandonados. Eso significa que sólo 5.4 millones de las mascotas mexicanas tienen hogar; el resto son callejeras. Así, México se ha convertido en el país con más abandono de animales en toda América Latina 22 todo ello aunado a los pobres niveles de higiene y sobrepoblación junto con la falta de atención veterinaria y conocimiento de las zoonosis exacerba los riesgos de transmisión de enfermedades, incluida la EAG. 23
Específicamente la incidencia de EAG es más alta en los que viven en el sur de los Estados Unidos (6.4 casos / 100,000 habitantes) y en los niños entre 5 a 9 años (9.4 casos/ 100,000 habitantes). Los pacientes hospitalizados han sido significativamente más propensos que los pacientes ambulatorios a ser varones. Se estima que cada año, 12,000 pacientes ambulatorios reciben un diagnóstico de EAG y 500 son hospitalizados. Las medidas de prevención (por ejemplo, control de pulgas para gatos) son particularmente útiles en los estados del sur y en hogares con niños. 24, 25
En México existen 23 millones de perros y gatos, población que supera a la de ancianos y niños menores de nueve años; y casi la misma que en conjunto registran el Distrito Federal y el Estado de México. De los 18 millones de perros, sólo 30 por ciento está en un hogar, es decir 5.4 millones; el resto son callejeros, Aunque la población que cuenta con gatos es aún menor, estos van ganando terreno en las casas de los mexicanos; por cada 100 personas, 20 tienen felinos y 80 perros.26
De igual forma en promedio 500.000 perros y gatos son abandonados al año. Una parte de ellos fueron adquiridos como regalos de navidad, día de Reyes y San Valentín, meses después los dueños pierden el interés en ellos. Esto es un problema de Salud Pública que hará que la enfermedad se haga endémica y que cada vez se detecten un mayor número de casos. En cuanto a cifras y estadísticas de EAG en hospitales de tercer nivel no existen serie de casos y los reportes de casos únicos generalmente son esporádicos. Lo que si sabemos es que actualmente los gatos ocupan un rol importante en la sociedad, ya que más que simples mascotas son considerados como un miembro dentro de las familias. Con esto se ha estrechado el contacto mascota-dueño y así se ha abierto la posibilidad de transmisión de ciertas enfermedades zoonóticas.
El periodo de incubación se considera desde el momento del arañazo hasta la aparición de la lesión cutánea primaria es de 3 a 12 días, promedio 7 días se observará la formación de una pápula El periodo desde la aparición de la lesión primaria hasta la presencia de linfadenopatía es de 5 a 50 días (el promedio de 12 días). Es por ello que en no pocas ocasiones el diagnóstico no se sospecha dado este lapso de tiempo muy prolongado. En un 25 a 30 por ciento ocurre supuración de ese ganglio y se puede confundir con otras causas de linfoadenitis aguda, patrón en línea de donde ocurre el rasguño, color amarillo, la adenopatía en ingle o axila de acuerdo al lugar de la inoculación pierna o brazo respectivamente. 27
En un estudio de 10 años en un seguimiento de 175 casos de EAG, la edad promedio de los casos fue de 7.4 años, más menos 4.4 años. Es decir, la edad de más afectación son los preescolares y los escolares. De ellos la gran mayoría en más del 80% correspondieron a varones. Otro estudio en el Sur de los Estados Unidos mostró una incidencia mayor en varones, en edades de 5 a 9 años (9.4 casos por 100 mil habitantes).
Algunos reportes mexicanos muestran casos en preescolares y mujeres aun cuando no es lo habitual. 28 Tiene distribución mundial, con mayor prevalencia en climas cálidos y húmidos generalmente causa una enfermedad leve en huéspedes inmunocompetentes.
El 55 % de los casos ocurre en niños menores de 18 años, y el 60% son hombres. Más de la mitad de los casos ocurren de septiembre a enero en los Estados Unidos. 29, 30 Se estima que 12,000 pacientes ambulatorios y 500 pacientes hospitalizados son diagnosticados con EAG anualmente. 31
Fisiopatología
Si bien la fisiopatología de la infección por las diferentes especies de Bartonella es compleja, 32 un rasgo común a todas ellas es su tropismo por los hematíes y por las células endoteliales. Los modelos de experimentación animal han permitido conocer que, tras la inoculación de las bacterias en sangre, estas desaparecen rápidamente del torrente circulatorio, permaneciendo estéril durante al menos 72 horas con posterioridad (del cuarto al quinto día tras la inoculación) estas bacterias reaparecen en sangre. Si bien no se conoce el primer nicho en el que se multiplican las bartonellas, existen evidencias que sugieren que esta multiplicación se realiza en las células endoteliales. Con posterioridad las bartonellas invaden los hematíes mediante la secreción de sustancias (deformina) que producen invaginaciones en la membrana del hematíe. Una vez que las bartonellas salen al exterior de los hematíes, vuelven a infectar las células endoteliales, lo que perpetúa el ciclo infeccioso. En las células endoteliales las bartonellas invaden su endotelio vascular, produciendo factores mitogénicos que actúan de forma local y temporal. Además, producen vasoproliferación por dos vías. Por un lado, algunas especies como B. henselae y B. quintana producen sustancias antiapoptosis, que retrasan la muerte celular. Por otro, libera factores vasoproliferativos como el factor de crecimiento del endotelio vascular (VEGF). Junto a todo lo anterior, la infección por Bartonella spp. produce diversas interleucinas (IL-6, IL-8, IL-10, etc.), alguna de las cuales atenúan los efectos de la respuesta inflamatoria. Específicamente B. Henselae tiene la posibilidad del desarrollo de cuadros clínicos más o menos graves se ha relacionado con la existencia de diversos genotipos. Recientemente se ha comunicado la presencia en B. henselae variedad Houston-1 (genotipo I), de un sistema de secreción tipo IV (T4SS) similar al sistema de virulencia de Agrobacterium tumefaciens, que podría hacer de esta una variedad más patógena. 33
El sello clínico es la linfadenopatía en el sitio de la inoculación. En el huésped inmunocompetente, se produce una respuesta granulomatosa. No así el huésped inmunocomprometido quien puede desarrollar una respuesta vascular proliferativa. Los ganglios linfáticos afectados se agrandan y se vuelven sensibles durante una o dos semanas. El bacilo puede diseminarse a los ojos, el hígado, el bazo y el sistema nervioso central (SNC). 1
Manifestaciones clínicas
Su sintomatología puede ser leve hasta grave o diseminada dependiendo del nivel de inmunocompetencia del individuo. En una persona inmunocompetente la principal manifestación CLASICA es una linfadenopatia/ linfadenitis regional, lo cual ocurre en un 85 a 90% de los casos. A menudo se encuentra inicialmente una pápula cutánea o una pústula en el supuesto sitio de inoculación y habitualmente precede al desarrollo de linfadenopatía en aproximadamente 1 a 2 semanas.
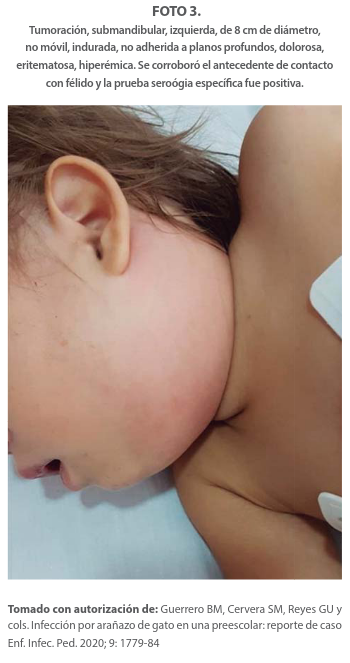
Los sitios comunes son los ganglios linfáticos axilares, epitrocleares, cervicales, supraclaviculares o submandibulares. La linfadenopatía puede durar de 1 a 4 meses. La piel que recubre los ganglios linfáticos afectados suele estar sensible, caliente, eritematosa e indurada. Estos datos que nos hablan de inflamación y son muy importantes para considerar en la anamnesis la convivencia con un gato. Foto 3.
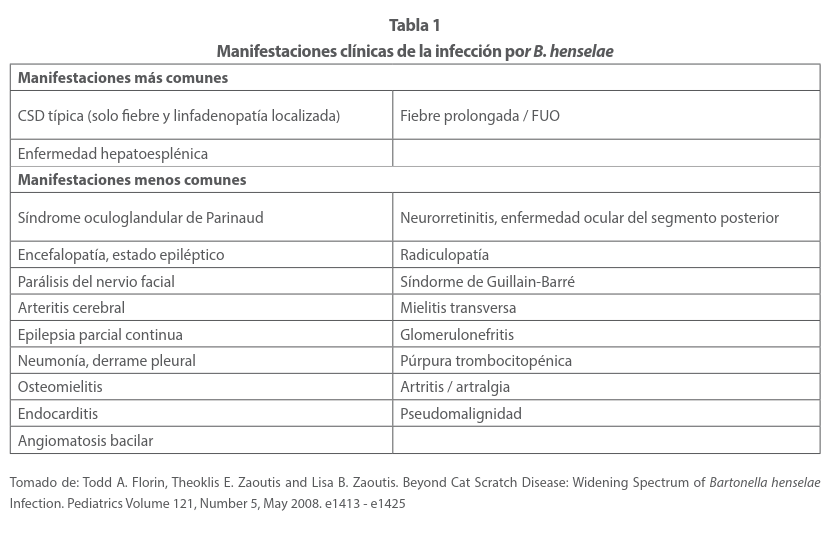
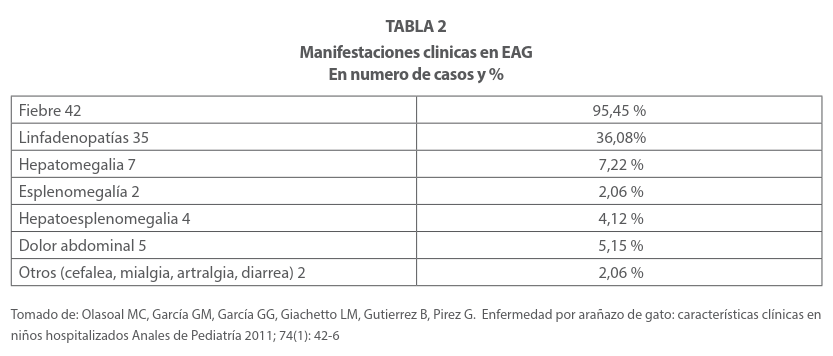
La afectación de los órganos viscerales puede incluir el hígado, el bazo o ambos y presentar fiebre, pérdida de peso y dolor abdominal. (tabla 1) En un 50% de los casos, se acompaña de fiebre, cefalea, hiporexia y mialgias, ocasionalmente exantema, conjuntivitis y convulsiones. Esta es la evolución del 90% de los casos que se resolverán entre 2 a 4 semanas en promedio. Pero un 10% puede cursar con complicaciones que pueden llevarle a la muerte, de aquí la importancia de un diagnóstico certero de esta enfermedad. De acuerdo con un estudio de casos, los datos clínicos más relevantes fueron: Fiebre en un 95.4%, linfadenopatís en un 36%, hepatomegalia 7%, esplenomegalia 2%, hepatoesplenomegalia 4%, dolor abdominal 5% y otros (cefalea, mialgias artralgias, diarrea) en un 2% Tabla 1 34
La inoculación del tejido periocular puede resultar en el síndrome oculoglandular llamada enfermedad de Parinaud que consiste en conjuntivitis folicular y linfadenopatía preauricular homolateral. El compromiso sistémico se observa en promedio entre el 5% al 20%, cuando esto ocurre puede causar una gran variedad de manifestaciones clínicas. Es por ello que esta se puede presentar como una adenopatía crónica autolimitada o bien en el espectro de una enfermedad sistémica grave, en consecuencia su sintomatología puede ir desde ser leve hasta grave o diseminada dependiendo del nivel de inmunocompetencia del individuo.
También puede presentarse con fiebre durante 1 a 3 semanas (es decir, fiebre de origen desconocido) y podría estar asociada con síntomas inespecíficos (malestar generalizado, dolor abdominal, cefalea, mialgias, etc), por ello siempre habrá de considerar esta enfermedad en el diagnóstico y estudio del niño con fiebre prolongada. 35 Un estudio efectuado en 35 pacientes que cumplían con los criterios descritos para fiebre de origen desconocido (FOD), el rango de edad fue de 6 meses a 15 años. Se obtuvo diagnóstico etiológico preciso en 74% de los pacientes estudiados. Dentro de las etiologías encontradas la más frecuente fue la infecciosa, en 24 pacientes (68%), destacando la infección por Bartonella Henselae como la más frecuente, seguida de la infección del tracto urinario (ITU) y la infección por virus Epstein-Barr (VEB). Cabe mencionar que los pacientes que presentaron infección por Bartonella Henselae, todos refirieron haber tenido contacto previo con gatos en la encuesta inicial. Asimismo, de todos los que refirieron contacto con gatos, un 66.6% desarrolló finalmente infección por Bartonella Henselae como condicionante del síndrome febril prolongado. Respecto al cuadro clínico de estos pacientes, uno sólo se presentó como EAG característica con lesión de inoculación en el antebrazo; tres se presentaron como síndrome febril prolongado con hepato-esplenomegalia identificada por hallazgo en la ecografía abdominal y dos se presentaron como síndrome febril prolongado aislado sin otras alteraciones. Todos ellos tuvieron serología positiva para B. Henselae con títulos de anticuerpos IgG de 1: 256 36. La presentación más clásica y frecuente de la Baronesa ocular es la neurorretinitis y se puede manifestar clínicamente como pérdida de la visión en forma súbita.
La gran mayoría de los casos ocurren en menores de 20 años, en preescolares y escolares, sobre todo del sexo masculino. También puede causar una retinocoroiditis focal o multifocal, panuveitis, arteria retiniana de la rama y oclusión de la vena, lo que lleva al desprendimiento de la retina. Las complicaciones neurológicas incluyen ataxia, parálisis de los nervios craneales y una imagen similar a la demencia en los ancianos. Los niños suelen presentar encefalitis o meningitis aséptica. Sin embargo, el estado epiléptico ha sido reportado. Una gran cantidad de quejas musculoesqueléticas se ha asociado con la enfermedad por arañazo de gato, que incluye artralgias, mialgias y artritis franca.
Otras manifestaciones menos frecuentes como encefalitis, neumonitis, endocarditis, púrpura trombocitopénica, eritema nudoso. En personas inmunocomprometidas las dos principales manifestaciones son la angiomatosis bacilar y la peliosis bacilar, todas ellas son más frecuentes en pacientes inmunocomprometidos (con tuberculosis, VIH, enfermedades reumatológicas y renales, o bien aquellos que estén recibiendo inmunosupresores o tratamiento para cáncer o fármacos inmnosupresores por trasplante renal 37-39 incluidos osteomielitis y enfermedad hepática crónica 40 así como endocarditis en pacientes con valvulopatía previa 41 Encefalitis asociada a neumonía con derrame plural, anemia hemolítica, adenitis mesentérica, depresión, endocarditis, pseudomononucleosis, meningitis aséptica, glomerulonefritis, neurorretinitis con pérdida aguda de la visión y conjuntivitis granulomatosa bilateral. 42
La pérdida súbita, brusca e indolora de la visión, con edema de papila, con una estrella macular más contacto reciente con un gato cachorro habrá que sospechar con primera opción EAG, incluso existe un reporte mexicano de un paciente con pérdida súbita de la visión y recuperación de está cuando se hizo el diagnóstico de EAG y manejo específico al caso, situación también documentada en reportes internacionales. 43-46 Otras manifestaciones poco frecuentes lo son la artritis séptica y la osteomielitis, habrá de considerar EAG en pacientes que no responden al tratamiento convencional, también se han reportado mieditis transversa y Síndrome de Guillain-Barré relacionada con EAG, y otras manifestaciones más raras como depresión. 47-50
Exámenes de laboratorio
La citometría hemática completa prácticamente se reporta normal, y solo los reactantes de fase aguda principalmente la Proteína C Reactiva se mantendrá en cifras elevadas y aunque es inespecífica nos hablará de un proceso inflamatorio de tipo infeccioso, algunos niños mostraran pruebas funcionales hepáticas alteradas.
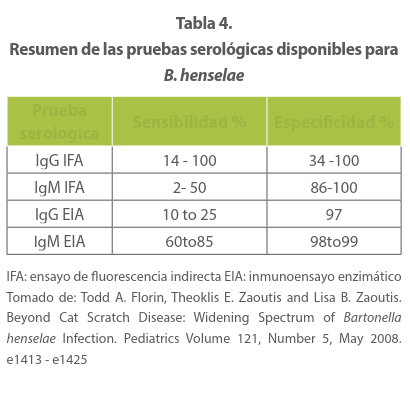
El aislamiento de B henselae mediante cultivo de rutina rara vez tiene éxito, tarda más de 6 semanas y es una bacteria fastidiosa difícil de cultivar. Por ello es poco práctico. Más útil es realizar pruebas serológicas específicas para B. henselae mediante inmunofluorescencia indirecta, que es muy sensible y específica. Los títulos de anticuerpos están altos en las primeras semanas después del comienzo de la aparición de las adenopatías La identifi cación del genoma de la B. henselae mediante PCR también ha demostrado ser muy sensible y específica. 51,52
Para el diagnóstico es útil la inmunofluorescencia indirecta con anticuerpos (indirect immunofluorescence antibody, IFA) para detectar anticuerpos séricos a los antígenos de especies de Bartonella. De acuerdo con el CDC (Center Disease Control and prevención en USA establece títulos de anticuerpos IgG mayores a 1:64 como evidencia positiva de infección por B. henselae, test específico para género (93-96%), pero no claramente definido para especies, dada la existencia de reacciones cruzadas. Prueba aún vigente pero no como prueba definitiva si es negativa (53) Pero también su positividad por reactivada cruzada se ha relacionado con otras entidades como Coxiella burnetii, Chlamydophila pneumoniae y otras especies de Bartonella. 54
Un reporte de Abarca y cols.55 sobre IFA y valores de IgM en 108 muestras de sueros de pacientes con EAG mostró que esta presentó una sensibilidad de 43% y una especificidad de 97%, Sus resultados sugieren que una IgM positiva apoya el diagnóstico de EAG, pero su negatividad no permite descartarlo. Por tanto, la IgG debe seguir considerándose como el estándar de oro para el diagnóstico de infecciones por B. henselae.
Un estudio realizado por Armitano y cols. 56 en 92 pacientes con EAG, mostró que la IgG es más específica para su diagnóstico, no así la IgM que en una buena parte de los casos se reportó negativa. Sin embargo, la negatividad de ambas no descarta el diagnóstico o la sospecha clínica.
Se han desarrollado inmunoanálisis enzimáticos para detectar anticuerpos a B. henselae, pero no son más sensibles ni específicos que el método IFA. En algunos laboratorios comerciales se practica la reacción en cadena de polimerasa.
El diagnóstico por serología o PCR tienen una sensibilidad 95% y especificidad del 97-99%. 57 Los títulos aceptados como negativos en cualquier momento de la evaluación son: IgM menor de I.20 y de IgG menor de 1.64 esta última se toma como criterio diagnóstica por parte del CDC de Atlanta.
Títulos de IgG <1:64 mantenidos por largos periodos (se mantienen hasta 6 meses después de la curación). IgM confirma la infección en los últimos 2 meses.
En conclusión: El ensayo de anticuerpos inmunofluorescente indirecto (IFA) para la detección de anticuerpos en suero a los antígenos de especies de Bartonella es útil, sin embargo debido a la reactividad cruzada con otras infecciones y una alta prevalencia entre la población general, es fundamental la correlación clínica. Y es que el diagnóstico microbiológico se basa en la detección de títulos elevados de anticuerpos (IgG/IgM) frente a B. henselae en la fase aguda de la enfermedad. No obstante, si el índice de sospecha de EAG es elevado y la serología inicial negativa se deberá repetir en 2-3 semanas. Además, se puede realizar PCR para B. henselae en sangre, tejidos y fluidos.
Cuando existen dudas diagnósticas se utiliza PCR en tiempo real para detectar el ADN de Bartonella henselae en 7,9% (5/63) de muestras de sangre de pacientes seronegativos en Japón con sospecha de enfermedad por arañazo de gato. Se recomienda el uso combinado de pruebas serológicas y PCR en tiempo real para analizar muestras de sangre para el diagnóstico de laboratorio rápido y no invasivo de la enfermedad por arañazo de gato. 58

Referencias bibliográficas
- Baranowski K, Huang B. Cat scratch Disease Last Update (2018) 25
- Mantis J, Ali Y, Junejo SZ. Cat-Scratch Disease in an AIDS Patient Presenting with Generalized Lymphadenopathy: An Unusual Presentation with Delayed Diagnosis. Am J Case Rep. 2018;19: 906-11.[PMC free article] [PubMed]
- Guerrero BM, León HS, Plascencia HA, Mercado UM, Martínez AP, Luévanos VA, Reyes HKL Reyes GU y cols. Enfermedad por arañazo de gato, experiencia del Hospital Civil de Guadalajara, México Bol Clin Hosp Inf Son 2018; 35(1): 61-9
- National Center for Infectious Diseases, Bacterial Zoonoses Branch: www.cdc.gov/ncidod/dvbid/misc/bzb.htm.
- Rosenman K. Zoonoses–Animals Can Make You Sick. Lansing, MI: Michigan State University; 1992. Página Web: www.cdc.gov/ nsad/docs/d000701-d000800/ d000752/d000752.html.
- Armitano R, Lisa A, Martínez C, Cipolla L, Lachini R, Prieto M. Bartonella henselae: evidencia serológica en pacientes pediátricos con sospecha clínica de enfermedad por arañazo de gato. Rev Arg Microb 2018; 50(4): 365-8
- American Academy of Pediatrics Cat Scratch disease in: KimberlIin DW, Brady MT, Jackson MA, Long SS. (edits) Red Book 2015 30ª ed. Elk Grace Village II.
- Robin ER. Cat-Scratch Disease. Pediatrics in review 2006; 27(4): 123-8 DOI: https://doi.org/10.1542/pir.27-4-123
- Reyes GU, López CG, Reyes KL, López DV. Enfermedad por arañazo de gato en: Castañeda JL, Ramírez SP. (edits) Prontuario de Infectología Pediátrica 6a. edición Asociación Mexicana de Infectología Pediatríca 2020
- Muñoz AL. Pesquisa serológica de Bartonella henselae en gatos Tesis Universidad de Chile 2007
- Abbott R, Chomel B, Wasten R, Floyd HK, Kikuchi Y, Koehler J, Pedersen N. Experimental and Natural Infection with Bartonella henselae in Domestic Cats. Comp. Immun. Microbiol. Infect. Dis. 1997; 20: 41-51.
- Gómez FG. Enfermedad por arañazo de gato Re Med Costar Centroamer 2013; 605: 109-11
- Canneti B, Cabo LI, Puy NA, García GJC, Cores FJ, Trigo M. Et al. Neurological presentations of Bartonella henselae infection. Neurol. Sci. 2019; 40(2): 261-8
- Mabra D, Yeh S, Shantha JG. Ocular manifestations of bartonellosis. Curr Opin Ophthalmol. 2018; 29(6): 582-7.
- Jost M, Latz A, Ballhorn W, Kempf VAJ. Development of a Specific and Sensitive Enzyme-Linked Immunosorbent Assay as an In Vitro Diagnostic Tool for Detection of Bartonella henselae Antibodies in Human Serum. J. Clin. Microbiol. 2018; 56 (12)
- Alfaro del Pozo A, Angulo LM, Amenero VR, Alvarez LA, Fernández CH, Barboza MJ, Rodríguez MA. Hepatosplenic Abscesses in an Immunocompetent Child With Cat-Scratch Disease From Peru. Ann Clin Microbiol Antimicrob 2019; 18(1): 15-23. doi: 10.1186/s12941-019-0322-0.
- Mazitelli M, Lambert AG et al. Utility of Molecular Identification and Quantitation of Bartonella Species with Species-Specific Real-Time PCR for Monitoring Treatment Response: A Case Series. Open Microbiol J. 2018; 12: 148-53
- Hernández MR, Reyes HKL, Reyes GU, Guerrero BM. Quero HA. Reyes HMU. Gastroenteritis en niños, asociada a mascotas Rev Enf Infec Microbiol 2020; 40(2):193-200
- Takashima GK, Day MJ. Setting the One Health agenda and the human-companion animal bond. Int J Environ Res Public Health. 2014; 11(11): 11110-20.
- López J, Abarca KV, Paredes P, Inzunza E. Parásitos intestinales en caninos y felinos con cuadros digestivos en Santiago, Chile. Consideraciones en Salud Pública. Rev Méd Chile 2006; 134:193- 200
- Instituto Nacional de estadística y geografía. México censo 2016
- https://ecoosfera.com/mexico-mascotas-abandono-perros- gatos-callejeros
- Galindo VE. Zoonosis por mascotas Tesis 2010 UNAM, INP.
- Nelson AC, Saha S, Mead SP. Cat-Scratch Disease in the United States, 2005-2013. Emerg Infect Dis. 2016; 22(10): 1741–6. doi: 10.3201/eid2210.160115
- Karski J, Matuszewski L, Okonski M, Pietrzyk D, Karska K. Cat Scratch Disease in a 1.5-year-old girl – Case report. Ann Agric Environ Med. 2018; 25(2): 345-8.
- Concho M. “business manager” de la empresa Purina en México.
- Robin English R. Cat-Scratch dIsease. Pediatrics in review 2006; 27(4): 123-8 DOI: https://doi.org/10.1542/pir.27-4-123
- Guerrero BM; Corvera SM, Mercado UM, Martínez AP, Luévanos VA, Plascencia HA, Reyes GU y cols. Enfermedad por arañazo de gato en una preescolar femenino: reporte de caso Rev Enf Inf Ped. 2020; 4: 1779-84
- Nelson CA, Moore AR, Perea AE, Mead PS. Cat scratch disease: U.S. clinicians’ experience and knowledge. Zoonoses Public Health. 2018; 65(1): 67-73.
- Windsor JJ. Cat-scratch disease: Epidemiology, etiology and treatment. Br J. Biomed Sci 2001; 58: 101-10
- Reynolds MG, Holman RC, Curns AT, O’Reilly M, McQuiston JH, Steiner CA. Epidemiology of cat-scratch disease hospitalizations among children in the United States.. Pediatr Infect Dis J. 2005; 24: 700-4
- Dehio C. Molecular and cellular basis of Bartonella pathogenesis.. Annu Rev Microbiol 2004; 58: 365-90.
- Blanco RJ, Raoult D. Enfermedades producidas por Bartonella spp. Enfermedades Infecciosas y Microbiología 2005; 23(5): 313- 20
- Olasoal MC, García GM, García GG, Gacheta LM, Gutierrez B, Pirez G. Enfermedad por arañazo de gato: características clínicas en niños hospitalizados Anales de Pediatría 2011; 74(1): 42-6
- Mori CJ, Salazar LLM, Salcedo EE. Enfermedad por arañazo de gato como causa de fiebre de origen desconocido: reporte de caso Rev Mex Ped 2019: 86(3): 123-5.
- Peredo GS, Viviani ST, Peña A. Etiología del síndrome febril prolongado en niños Rev Chil Pediatr 2007; 78 (5): 472-6.
- Aguilar F, Martins RT, Brito I. Seronegative cat scratch disease in a patient with systemic lupus erythematosus. Acta Reumatol Port. 2018; 43(3): 241-2
- Mantis J, Ali Y, Junejo SZ Cat-Scratch Disease in an AIDS Patient Presenting with Generalized Lymphadenopathy: An Unusual Presentation with Delayed Diagnosis. Am J Case Rep. 2018; 19: 906-11.
- Encina BZ, Acosta NM, Gil VM. Enfermedad por arañazo de gato en una paciente con trasplante renal Enf. Inf. Microbiol 2017; 37(3): 105-8
- Mathews DM, Vance KM, McMahon PM, Boston C, Bolton MT An Atypical Case of Bartonella Hinsdale Osteomyelitis and Hepatic Disease.Case Rep Pediatr. 2018; 5: 2750-7
- Vercellone J, Cohen L, Mansuri S, Zhang PL, Kellerman PS. Bartonella Endocarditis Mimicking Crescentic Glomerulonephritis with PR3-ANCA Positivity. Case Rep Nephrol. 2018; 192:9607582
- Samarkos M, Antoniadou V, Vaiopoulos AG, Psichogiou M. Encephalopathy in an adult with cat-scratch disease. BMJ Case Rep. 2018; 5; 2018.
- Valor C, Huber K. Atypical presentation of cat scratch disease: Parinaud’s oculoglandular syndrome with facial nerve paresis. BMJ Case Rep. 2018; 6; 2018-78
- Del Valle WD. Neurorretinitis por Bartonella henselae: presentacion.De un caso y revisión de la literatura Red Mex Oftalmología 2016; 90(5): 235-41
- Mabra, Yeh S, Shantha JG. Ocular manifestations of bartonellosis. Curr Opin Ophthalmol. 2018; 29(6): 582-7.
- Abdelhakim A, Rasool N. Neuroretinitis: a review. Curr Opin Ophthalmol. 2018; 29(6): 514-9.
- Donà D, Nai FL, Mozzo E, Cabrelle G, Bordin G, Lundin R, et al. Osteomyelitis in Cat-Scratch Disease: A Never-Ending Dilemma-A Case Report and Literature Review. Case Rep Pediatr. 2018; 4(1): 1679306. doi: 10.1155/2018/1679306
- Rafee Y, English BK. Skull osteomyelitis as a rare complication of cat scratch disease. Avicenna J Med. 2018; 8(4): 157-9.
- Zakhour R, Mancias P, Heresi G, Pérez N. Transverse Myelitis and Guillain-Barré Syndrome Associated with Cat-Scratch Disease, Texas, USA, 2011. Emerg Infect Dis. 2018; 24(9): 1754-5.
- Flegr J, Preiss M, Balátova P. Depressiveness and Neuroticism in Bartonella Seropositive and Seronegative Subjects-Preregistered Case-Controls Front Psychiatry. 2018; 13(9): 314.
- Martín DM, Rubio FC, Corral de la CM, Lucas LR. Enfermedad por arañazo de gato. Anales de Pediatría 2006; 66(5): 506-8
- Metzkor CE, Kletter Y, Avoider B, Varon M, Golan Y, Ephros M, et al.. Long-term serological analysis and clinical follow-up of patients with cat scratch disease Clin Infect Dis 2003; 37: 1149-54
- Bass J, Vincent J, Person D. The expanding spectrum of Bartonella infections: II. Cat-scratch disease. Pediatr Infect Dis J 1997; 16: 163-79.
- Aydin N, Bülbül R, Tellı M, Gültekin B. Seroprevalence of Bartonella Hinsdale and Bartonella quintana in blood donors in Aydin province, Turkey Mikrobiyol Bul. 2014; 48: 477-83
- Abarca K, Winter M, Marsac D, Palma C, Contreras MA, Ferrés M.Accuracy and diagnostic utility of IgM in Bartonella henselae infections Rev Chil Ped 2013; 30(2): http://dx.doi. org/10.4067/S0716-10182013000200001
- Armitano R, Lisa A, Martínez C, Cipolla L, Iachini R, Prieto M. Bartonella henselae: Serological evidence in pediatric patients with clinical suspicion of cat scratch disease. Rev Argent Microbio 2018; 50(4): 365-8
- Vermeulen MJ, Herremans M, Verbakel H, Bergmans MA, Rohr JJ, Dijken JP, Peeters FM. Serological testing for Bartonella henselae infections in The Netherlands: Clinical evaluation of immunofluorescence assay and ELISA Clinical Microbiology and Infection 2007; 13(6): 627-34
- Yanagihara M, Tsuneoka H, Tanimoto A, Otsuyama KI, Nishikawa J, Matsui T, Nojima J, Ichihara K. Bartonella henselae DNA in Seronegative Patients with Cat-Scratch Disease. Emerg Infect Dis. 2018; 24(5): 924-5.
- Todd A. Florin, Theoklis E. Zaoutis and Lisa B. Zaoutis. Beyond Cat Scratch Disease: Widening Spectrum of Bartonella henselae Infection. Pediatrics Volume 121, Number 5, May 2008. e1413 – e1425
Martínez-Arce P.(1), Reyes-Gómez U.(2)(3), Guerrero-Becerra M.(1), Aquino-Villagómez D.(2), Reyes-Hernández K.L.(4), Matos-Alviso L.J.(2), Arista-Viveros H.A.(2), Miranda-González D.(2), Hernández-Magaña R.(2), Alonso-Pérez N.C.(2), Anzures-Gutiérrez S.A.(2), Carreón-Guerrero J.M.(2), Espinosa-Sotero C.(5).
- Departamento de infectología Pediátrica Antiguo Hospital Civil, Guadalajara Jalisco;
- Grupo de Investigación en Infectología Pediátrica GIIP;
- Unidad de Investigación en Pediatría. Instituto San Rafael San Luis Potosi;
- Residente de Neonatologia Instituto Nacional de Perinatologia, México;
- Servicio de infectología Pediátrica Hospital General de México.

