Efectos del extracto acuoso del fruto de averrhoa carambola sobre algunos aspecto del metabolismo de la glucosa
Resumen
El presente trabajo tiene como objetivo establecer si en el extracto acuoso del fruto de Averrhoa carambola, existen compuestos que sean útiles en el tratamiento de la diabetes.
Se demostró que el extracto acuoso del fruto de la planta disminuyo la actividad de la glucosa-6-fosfatasa microsomal hepática, especialmente en microsomas intactos, por inhibir principalmente al transportador T1 y en menor cuantía a la subunidad catalítica de la enzima, y en consecuencia probablemente inhiba la capacidad neoglucogénica del hígado. Adicionalmente se encontró que el extracto del fruto de A. carambola disminuyo la absorción intestinal de glucosa. Estos 2 efectos reducirían el aporte de glucosa a la sangre y en consecuencia tienen un efecto antihiperglicemiante.
Por el contrario se observó que el extracto acuoso del fruto de A. carambola estimula la síntesis de glucógeno del músculo diafragma posiblemente por incrementar la traslocación del GLUT4 a la membrana plasmática, éste resultado sugiere que en el fruto de la planta existe(n) compuesto(s) con actividad insulinomimética, en consecuencia tienen un efecto hipoglicemiante.
Mediante el uso de cromatografía liquida al vacío se fracciono el liofilizado del extracto acuoso del fruto utilizando los solventes: diclorometano, acetona y metanol; por cromatografía de capa fina y por el uso de varios reveladores se identificó tentativamente los compuestos presentes en las fracciones obtenidas como polifenoles y compuestos oxigenados no terpenoidales, de polaridad media. Las fracciones con la mayor actividad inhibitoria sobre la glucosa-6-fosfatasa fue la soluble en acetona-metanol.
Finalmente se puede sugerir que el extracto acuoso del fruto de A. carambola, pudiera ser útil en el control de la hiperglicemia del diabético y estimula a continuar el fraccionamiento de dicho extracto para purificar el (los) compuesto(s) activos.
Palabras claves: Averrhoa carambola, diabetes, glucosa-6-fosfatasa, neoglucogénesis, glucogenólisis, glucogenogénesis, absorción intestinal de glucosa.
The aims of the present work is to establish if in the aqueous extract of Averrhoa carambola there are compounds useful in the treatment of diabetes.
It was demonstrated that the aqueous extract of the fruit, decrease the activity of the hepatic microsomal glucose-6-phosphatase, mainly in the intact microsomes and in less extend in disrupted microsomes, due to a higher inhibition of the T1 transporter in comparison to the effect on the catalytic subunit of the enzyme; in consequence it probably reduce the gluconeogenesis capacity of the liver. The extract of the fruit also decrease the intestinal absorption of glucose. These two effects reduce the supply of glucose to the blood and in consequence they have an anti-hyperglycemic effect.
On the other hand, the aqueous extract of the fruit of the A. carambola increased the glycogenogenesis of the diaphragm muscle probably due to a higher translocation of the GLUT4 to the plasma membrane. These result suggest that in the fruit of the plant here is (are) compound(s) insulin mimetic, in consequence they exert a hypoglycemic effect.
The freeze dry of the aqueous extract of the A. carambola fruit was fractionated using vacuum liquid chromatography, with the solvents: dichloromethane, acetone and methanol. By the use of thin layer chromatography and different developers, the compounds present in the fruit extract and its fraction were tentative identify as polyphenols and oxygenated compounds no terpenoids of medium polarity. The fraction soluble in acetone-methanol was the most effective inhibiting the glucose-6-phosphatase.
The above results allow to suggest that the aqueous extract of the fruit of the A. carambola may be useful in the treatment of the hyperglycemia of the diabetic patients and stimulate to continue fractionating the extract in order to purify the active compound(s).
Key words: Averrhoa carambola, diabetes, glucose-6-phosphatase, gluconeogenesis, glycogenogenesis, glycogenolisis, glucose intestinal absorption.
INTRODUCCIÓN
La glicemia es un parámetro homeostático controlado muy eficientemente gracias al equilibrio que existe entre los mecanismos que aportan y remueven la glucosa de la sangre. La absorción intestinal de glucosa es uno de los mecanismos que aportan el carbohidrato a la sangre y ocurre en dos etapas, uno en la membrana apical catalizado por el SGLT1 y el otro en la membrana vasolateral catalizado por el GLUT2 (Nelson and Cox, 2005).
Durante un periodo corto de ayuno, el glucógeno hepático es degradado (glucogenolísis) con la finalidad de aporta glucosa a la sangre; si el ayuno se prolonga ocurre la síntesis de glucosa (neoglucogénesis) especialmente en hígado y riñón; la reacción final de ambos procesos es catalizado por la glucosa-6-fosfatasa (G-6-Pasa, EC 3.1.3.9) que hidroliza la glucosa-6-fosfato dando fosfato y glucosa, la cual puede pasar a la sangre, en consecuencia ésta enzima juega un importante papel en el mantenimiento de la glicemia (Ashmor and Weber, 1959). La G-6-Pasa se encuentra en el retículo endoplasmático, el cual es el principal componente de la fracción microsomal, y está constituida por un transportador para glucosa-6-fosfato denominado T1, muy específico, y la subunidad catalítica (González-Mujica y Bermúdez, 2017). En los microsomas intactos se requiere de la participación de ambos componentes para que la reacción enzimática ocurra, pero al romper los microsomas, por diversos medios como el uso de histonas (Benedetti et al. 2002) solo interviene la subunidad catalítica en la reacción.
Los transportadores de glucosa, GLUTs (Joost and Thorens, 2001) median el transporte facilitado del carbohidrato dentro y fuera de las células, de particular interés es el GLUT4 el cual se encuentra en músculo esquelético, músculo cardíaco y tejido adiposo. El GLUT4 se encuentra localizado en vesículas intracelulares y por acción de la insulina es translocado a la membrana plasmática incrementándose la entrada de glucosa a dichas células disminuyendo la glicemia.
Desde tiempos inmemoriales los humanos han usado plantas en el tratamiento empírico de diversas enfermedades y en particular de la diabetes. Una de estas plantas es Averrhoa carambola L., conocida vulgarmente en Venezuela, como tamarindo chino o carambola o fruto estrella. La planta pertenece a la familia de las oxalidáceas y cuyos frutos son bayas gruesas indehiscentes (5 a 8 cm), de color verde amarillento, azucarada y ácida, se ha señalado que dichos frutos tienen propiedades medicinales entre ellas capacidad hipoglicemiante (Castillo-Minaya et al. 2013). En el presente trabajo nos propusimos estudiar los efectos que el extracto acuoso del fruto de A. carambola ejercen sobre la enzima G-6-Pasa hepática usando microsoma intactos y rotos, sobre la absorción intestinal de glucosa y sobre la glucogenogenésis muscular.
Adicionalmente fraccionaremos el liofilizado del extracto acuoso del fruto de la planta, caracterizamos parcialmente los compuestos presentes en el extracto acuoso del fruto y sus fracciones y estudiaremos los efectos que las fracciones obtenidas ejerzan sobre la G-6-Pasa.
MATERIALES Y MÉTODOS
Animales
Para todos los experimentos se utilizaron ratas machos de la cepa Sprague-Dawley con un peso entre 180-250 g de la colonia endogámica del Instituto de Medicina Experimental de la Facultad de Medicina de la Universidad Central de Venezuela.
Planta y preparación de extracto
La planta, Averrhoa carambola, fue identificada por el Dr. Stephen Tillet del Herbario Ovalles de la facultad de Farmacia de la Universidad Central de Venezuela. El fruto fue cosechado en mayo del 2017, luego de lavado y seco, se cortó en trozos, se le agregó agua, se licuó y filtró, dicho extracto se usó para los ensayos con la enzima G-6-Pasa, la absorción intestinal de glucosa y la gluconeogénesis muscular. Alícuotas del extracto acuoso del fruto fueron secadas con la finalidad de cuantificar el material sólido presente.
Preparación de los microsomas
Los microsomas de hígado de ratas ayunadas por 24 horas, fueron preparados como describió Marcucci et al. (1983) y usados como fuente de la enzima G-6-Pasa. Una vez extraído el hígado, éste se homogenizó en sacarosa 0,32 M, MgCl2 3 mM en un homogeneizador de Teflón-Vidrio, a 4° C. El homogeneizado se centrifugó a 20.000xg por 20 min a 4°C en una centrífuga Sorval RC5 para la sedimentación de núcleo y mitocondrias, seguidamente el sobrenadante se centrifugó a 105.000xg 1 hora a 4°C en una Beckman L5-75 ultracentrífuga. Finalmente, el sedimento se resuspendió en sacarosa 0,25 M, HEPES 5 mM, MgCl2 1 mM (pH 6,5), aproximadamente 1 ml de la solución por gramo de hígado. Las proteínas presentes en la fracción microsomal se cuantificaron por una modificación del método de Lowry (Markwell et al. 1978).
Actividad de la glucosa-6-fosfatasa (G-6-Pasa) microsomal
La actividad de la G-6-Pasa se midió en un volumen final de 100 μL siguiendo la metodología descrita por Burchell et al.(1988). En tubos de ensayo, por triplicado, se colocaron 40 μL de glucosa-6-fosfato 12,5 mM, 16 mM HEPES, 20 mM EDTA (pH 6,5) para los microsomas intactos y con la adición de 80 μg de histonas para los microsomas rotos. Se adicionó 40 µL de agua destilada ó 20% DMSO, para los controles, ó 40 µL del extracto acuoso de la planta o de las fracciones obtenidas. La reacción se inició con la adicción de 20 μL de microsomas (aproximadamente 20 µg de proteínas). Luego de 10 min a 30 ºC la reacción se detuvo con la adición de 900 μL del reactivo que contiene 1 volumen de 10% ácido ascórbico, 2 volúmenes de 5% SDS y 6 volúmenes de 4,2% molibdato de amonio en 0,5 M H2SO4 y el color se desarrolló a 45ºC por 20 min, luego la absorbancia se leyó a 820 nm para cuantificar el fosfato liberado por la enzima.
Absorción intestinal de glucosa
La absorción intestinal de glucosa fue estudiada como describieron González-Mujica et al. (2007). Las ratas, ayunadas por 48 horas, fueron anestesiadas con pentobarbital sódico (60 mg/Kg de peso corporal), se realizó una incisión media desde el apéndice xifoides hasta el pubis. Se localizó el extremo distal del duodeno y se aislaron, mediante ligaduras, 4 segmentos consecutivos, cada uno de 4 cm de longitud. Utilizando inyectadoras para insulina se inyectó 1ml de 10 mM de glucosa, 0,145 M NaCl en los controles y a los experimentales 10 mM glucosa, 0,145M NaCl más alícuotas del extracto del fruto de la planta. Luego de 30 min se colectó el líquido remanente en cada segmento intestinal y se determinó la glucosa por el método de glucosa-oxidasa-peroxidasa (Trinder 1969) la cantidad de glucosa absorbida se estableció por diferencia.
Glucogenogénesis muscular
La gluconeogénesis del diafragma de rata fue estudiada de acuerdo a lo descrito por González-Mujica et al. (2004). Las ratas, ayunadas por 48 horas, fueron sacrificadas por dislocación cervical y se extrajeron sus diafragmas. Cada diafragma se dividió en cuatro segmentos, de aproximadamente igual peso, eliminando el tejido tendinoso central. Todos los segmentos fueron incubados en 4 ml Krebs-HEPES (Werling et al. 1984) suplementado con 5 mM de glucosa, en atmosfera de oxígeno por 90 minutos. Uno de los segmentos se incubó en ausencia de insulina, el segundo se incubó en presencia de insulina (1mU/mL Eli Lilly y Co México), el tercero y el cuarto se incubaron en presencia de cantidades variables del extracto del fruto de la planta (ver Tabla 3).
Después de la incubación, el glucógeno fue purificado (Varkonyil et al. 1980) para lo cual los segmentos de diafragma fueron pesados, y se les adicionó 3 volúmenes de KOH al 60%, luego se llevó a ebullición por 30 minutos. Después de frio, se agregó una mezcla de etanol-NaCl (7 vol. Etanol: 1 vol. de NaCl 2%) el doble del volumen de la suma del peso del tejido + volumen de KOH usado, se guardó a -20°C por 12 horas. Posteriormente se centrifugó a 3000xg por 10 min a 4°C, se descartó el sobrenadante, y el precipitado fue resuspendido en un 1 ml de etanol/NaCl, luego de 15 minutos a -20 °C se centrifugar como antes, y el precipitado fue resuspendido en un 1 ml de H2O bidestilada. El glucógeno, así obtenido, se midió con antrona de acuerdo al método de Seifter et al. (1950).
Fraccionamiento parcial del extracto acuoso del fruto de A. carambola
El extracto acuoso del fruto de A. carambola se liofilizó y el sólido obtenido fue absorbido en silica, luego se procedió a realizar cromatografía líquida al vacío (VLC), con tres solventes en el siguiente orden, diclorometano (Ac-1) 20ml x 6 veces, acetona (Ac-2) 20ml x 6 veces y finalmente metanol (Ac-3) 20ml x 6 veces. En la fracción metanólica se observó una parte insoluble (Ac-5), la cual se separó y se trató con en acetona obteniéndose una parte soluble, la fracción (Ac-4), y una parte insoluble, esta se unió con la fracción insoluble (Ac-5). La fracción obtenida con diclorometano (Ac-1) contenía tan poco material sólido que no pudo ser utilizada en los análisis ulteriores. Los análisis preliminares mostraron que la fracción (Ac-3) no modifico la actividad de la enzima G-6-Pasa por lo cual tampoco fue analizada. Por lo antes expuesto se estudiaron 3 fracciones: 1) acetona (Ac-2), 2) soluble en acetona-metanol (Ac-4), 3) insoluble en acetona-metanol (Ac-5) y de cada una de ellas, se prepararon soluciones de 5 mg /ml de DMSO al 20%.
Análisis por TLC de las fracciones obtenidas por cromatografía líquida al vacío del extracto acuoso del fruto de A. carambola
Alícuotas del extracto acuoso del fruto de la planta y de las fracciones: acetona (Ac-2), acetona-metanol (Ac-4) e insoluble en acetona-metanol (Ac-5) fueron sembradas en placas de silica gel y desarrolladas con una de las siguientes mezclas de solventes: acetato de etilo-ácido acético-ácido fórmico-agua (100:11:11:27;v/v/v/v) para compuestos de alta polaridad; acetato de etilo-metanol-agua (100:13,5:10;v/v/v) para compuesto de mediana polaridad o hexano-acetato de etilo-ácido fórmico (75:25:1;v/v/v)paracompuestos de baja polaridad. Se emplearon los siguientes reveladores: anisaldehido en ácido sulfúrico para aceites esenciales y saponinas; Daggendorf para alcaloides y NP/PEG (éster del ácido-β-etilamino difenilborico metanólico al 1%, polietilglicol etanólico al 5%) para flavonoides. Las TLC, una vez desarrolladas y reveladas, fueron observadas bajo luz visible, a 254 nm y 365 nm.
Análisis estadístico
Los datos obtenidos fueron analizados con el programa estadístico GraphPad Prism 6 versión 6.07. Se utilizó la prueba estadística t-Student para determinar si las diferencias eran significativas. Las diferencias entre las medias del 5% (p<0,05) fueron consideradas significativas. Y se utilizó un análisis de varianza (ANOVA) de dos vías comparando tratamiento con extractos obtenidos del fraccionamiento por cromatografía líquida al vacío.
RESULTADOS
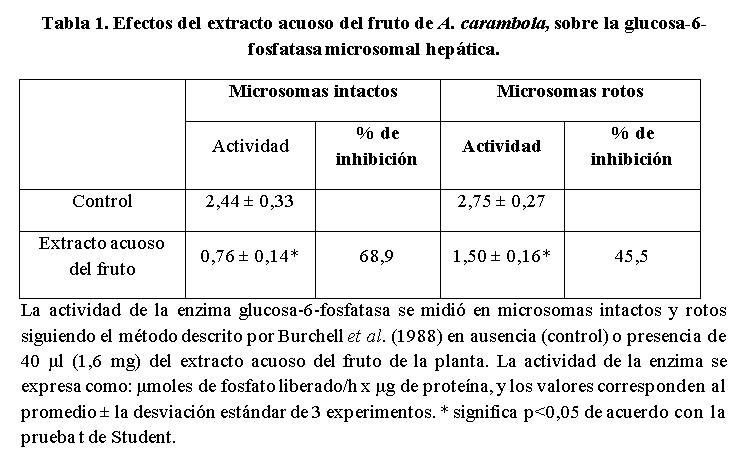
En la Tabla 1 se muestra el efecto del extracto acuoso del fruto de A. carambola sobre la G-6-Pasa microsomal hepática, como puede observarse, se obtuvo un mayor efecto inhibitorio en los microsomas intactos que en los rotos, sin embargo el efecto sobre estos últimos no es despreciable; el mayor efecto inhibitorio sobre la enzima de microsomas intactos incrementó la latencia la cual paso de 11,3% en los controles a 49,3% en los microsomas tratados con el extracto acuoso del fruto de la planta. Como se muestra en Tabla 2, la cantidad de glucosa absorbida en presencia del extracto acuoso del fruto de A. carambola disminuyó moderadamente, sin embargo el cambio fue estadísticamente significativo en relación al control.
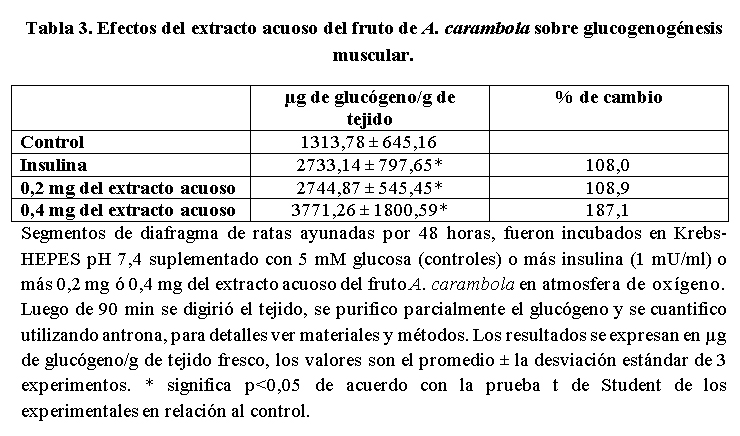
En la Tabla 3 se muestra los efectos del extracto acuoso del fruto de A. carambola sobre la glucogenogénesis muscular. Los segmentos de diafragma incubados en presencia de insulina contienen el doble de la cantidad de glucógeno que los controles, valor que fue prácticamente igual al encontrado en los segmentos de diafragma incubados en presencia de 0,2 mg del extracto acuoso del fruto de la planta; la duplicación de la cantidad del extracto del fruto en el medio de incubación incremento la cantidad de glucógeno presente en casi 2,9 veces en relación con el control.
Dada las características de la migración cromatográfica de los compuestos presentes en el extracto acuoso del fruto de A. carambola y en las fracciones obtenidas a partir de él por cromatografía líquida al vacío y la coloración de las mismas con los reveladores usados, se puede sugerir que sólo contiene polifenoles y compuestos oxigenados no terpenoidales. Tampoco se encontraron metabolitos secundarios del tipo alcaloidal. No se encontraron flavonoides y los polifenoles presentes fueron mayoritariamente metabolitos del tipo ácido fenil propanoides, los cuales son los precursores de los compuestos polifenólicos del tipo flavonoide. En la fracción Ac-4 (soluble acetona-metanol) se concentraron los metabolitos de características polifenólicas.
La presencia de DMSO, 8% de concentración final en el ensayo, no modifico la activada de la enzima en los controles ni en presencia del extracto acuoso del fruto de la planta (Tablas 1 y 4).
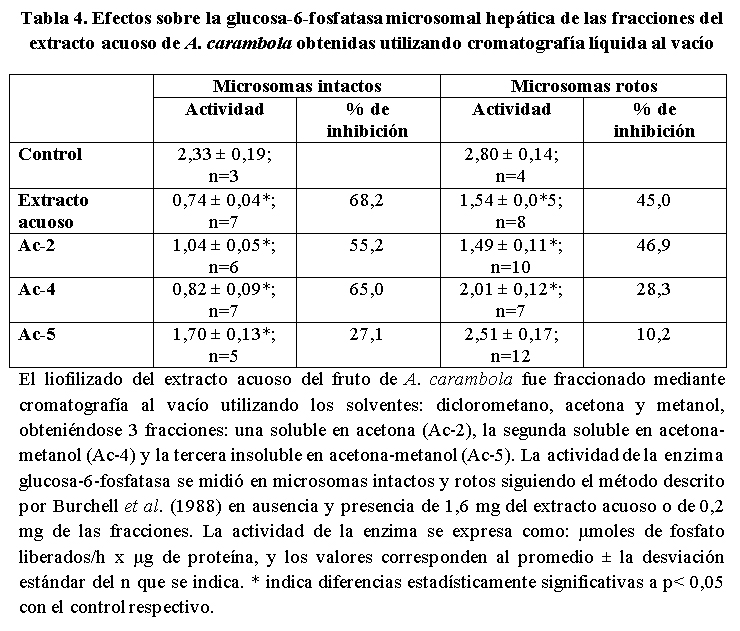
Como se observa en la tabla 4, las fracciones: de acetona (Ac-2), soluble en acetona-metanol (Ac-4) e insoluble en acetona-metanol (Ac-5), obtenidas a partir del liofilizado del extracto acuoso del fruto de A. carambola por cromatografía líquida al vacío, inhibieron la actividad de la G-6-Pasa microsomal hepática más intensamente en los microsomas intactos que sobre los rotos, efecto similar al observado con el extracto acuoso. La fracción más efectiva fue la soluble en acetona-metanol (Ac-4) y la menos efectiva la insoluble en acetona-metanol (Ac-5). Es interesante destacar que con el fraccionamiento del extracto acuoso del fruto de la planta se concentraron el (los) compuesto(s) activos ya que del extracto acuosos se usaron 1,6 mg para obtener una inhibición del 68,5 y de la fracción Ac-4 solo 0,2 mg para obtener una inhibición del 65,0%, ambas en microsomas intactos.
DISCUSIÓN
En las Tablas 1 y 4, se pueden observar los valores de los controles obtenidos al medir la actividad de la G-6-Pasa en microsomas hepáticos intactos y rotos, por el uso de histonas, son similares a los reportados por otros (González-Mujica y Motta, 2010); es interesante destacar que la actividad de la enzima se incrementa al romper los microsomas aspecto que es característico de las enzimas unidas a membranas y se denomina latencia. Tanto el extracto acuoso del fruto de A. carambola como las fracciones obtenidas a partir de él mostraron una mayor inhibición sobre la G-6-Pasa de microsomas intactos en comparación con la observada en los microsomas rotos (Tablas 1 y 4), lo cual sugiere que en el extracto acuoso y sus fracciones, están presentes compuesto(s) que ejercen una mayor inhibición sobre el transportador de glucosa-6-fosfato (T1) que sobre la subunidad catalítica del sistema de la G-6-Pasa (González-Mujica y Motta, 2010). Se han reportado una variada gama de compuestos capaces de inhibir T1, entre los cuales mencionaremos: ácido clorogénico, floricina, ácido 3-mercaptipinolico (Khan et al. 1998) y flavonoides tales como quercetina galoil ramnosa y kanferol galoil ramnosa (Estrada et al. 2005). Una amplia lista de inhibidores de T1 ha sido reportada por González-Mujica y Bermúdez (2017).
Como puede observarse en la Tabla 3, los segmentos de músculo diafragma fueron capaces de realizar glucogenogénesis a partir de glucosa y dicho valor se incrementó considerablemente en la presencia de insulina y fueron similares a las reportados por otros (González-Mujica et al. 2004) indicando que las condiciones experimentales usadas son adecuadas para estudiar esta vía metabólica. La incubación de los segmentos de diafragma en presencia del extracto acuoso del fruto de A carambola incremento la glucogenogénesis de una manera dosis dependiente (Tabla 3) dicho incremento puede deberse a un aumento en la actividad de las enzimas que participan en dicha vía metabólica tales como la glucógeno sintasa y la UDP-glucosa pirofosforilasa, más sin embargo la entrada de glucosa a la célula muscular es un prerrequisito para la síntesis de glucógeno. La entrada de glucosa a la célula muscular esta mediado por el GLUT4 y la ubicación de dicho transportador en la membrana plasmática de estas células dependen de la insulina (González-Mujica 2017). Por lo antes mencionado, es posible sugerir que en el extracto del fruto de la planta existen compuesto(s) que estimulan la glucogenogénesis muscular por incremento de la entrada de glucosa a dichas células probablemente por un mecanismo similar al de la insulina, por lo cual se puede sugerir que los polifenoles presentes en el extracto acuoso del fruto de la planta ejercen un efecto insulino mimético (González-Mujica et al. 2004). Vale la pena mencionar que el ácido clorogénico (Tunnicliffe, et al. 2015) ha sido señalado como un compuesto capaz de incrementar la translocación del transportador GLUT4 a la membrana plasmática desde vesículas intracelulares. En la fracción soluble en acetona-metanol (Ac-4) se encontró la mayor proporción de polifenoles del tipo ácido fenil propanoicos y fue la que exhibió el mayor porcentaje de inhibición de la G-6-Pasa microsomal hepática (Tabla 4); lo anteriormente expuesto sugiere que los polifenoles presentes en dicha fracción son responsables del efecto observado. La inhibición de la G-6-Pasa microsomal hepática (Tablas 1 y 4), enzima que cataliza la reacción final de los procesos de glucogenolísis y neoglucogésis (González-Mujica y Motta, 2010), mediada por el extracto acuoso del fruto de A. carambola, traería como consecuencia una disminución del aporte de glucosa del hígado a la sangre, presentando en consecuencia un efecto antihiperglicemiante. La reducción de la capacidad del intestino delgado de absorber glucosa por efecto del extracto acuoso del fruto de la planta (Tabla 2) también disminuirá el aporte de glucosa a la sangre mostrando un efecto antihiperglicemiante. El incremento de la glucogenogénesis muscular por efecto del extracto acuoso del fruto de A. carambola (Tabla 3) por un posible aumento de la entrada de glucosa a dicho tejido tendría un efecto hipoglicemiante. Los tres aspectos antes mencionados, inhibición de la G-6-Pasa microsomal hepática, inhibición de la absorción intestinal de glucosa e incremento de la glucogenogénesis muscular por efectos del extracto acuoso del fruto de A. carambola, sugieren fuertemente que en dicho extracto están presente compuesto(s) que pudieran ser útiles en el tratamiento de la hiperglicemia del diabético. Los resultados aquí presentados son un estímulo para continuar realizando el análisis fitoquímico, del fruto de A. carambola, con la finalidad de purificar el (los) compuesto(s) presentes en el mismo y que sonresponsables del efecto biológico y de esta manera incremental el arsenal terapéutico de la diabetes.

Bibliografía
- Ashmor J and Weber G. (1959). The role of hepatic glucose-6-phosphatase in the regulation of carbohydrate metabolism. In Vitamins and Hormones, Harris, RS. and Morrison, GF. (ed.) Academic Press: New York. 26: 91-132.
- Benedetti A, Fulceri R, Allan BB, Houston P, Sukhodub AL, Marcolongo P, Ethell B, Burchell B and Burchell A. (2002). Histone 2A stimulates glucose-6-phosphatase activity by permeabilization of liver microsomes, Biochem. J. 367: 505-510.
- Calhau C, Faria A, Keating, E and Martel F. (2014). Interaction of polyphenols with the intestinal and placenta absortion of some nutrients and other compounds. Polyphenols in human health and disease, Chapter 39-523-537.
- Castillo-Minaya K, Castillo-Minaya E y Huamán-Saavedra J. (2013). Efecto de la Averrhoa carambola L. o “carambola” vs. Gemfibrozilo sobre el perfil lipídico en Rattus rattus var albinus. Acta Med. Per. 30: 136-141.
- Estrada O, Hasegawa M, Gonzalez-Mujica F, Motta N, Perdomo E, Solorzono A, Méndez J, Méndez B, Zea EG (2005). Evaluation of flavonoids from Bauhinia megalndra leaves as inhibitors of glucose-6-phosphatase system. Phytotherapy Res. 19: 859-863.
- Frejnagel S. (2007). Comparison of polyphenolic composition of extracts from honeysuckle, chokeberries and Green tea. Pol. J. Food Nutr. Sci. 25:83-86.
- González-Mujica F y Bermúdez J (2017). El sistema de la glucosa-6-fosfatasa. Algunos de sus inhibidores. Editorial Académica Española. Alemania. ISBN 978-3-639-53865-6.
- González-Mujica F, Motta N and Balzano L. (2004).Momordica charantia fruits aqueous extract increase diaphragma glucogenogenesis from [U14C]-glucose. The 8th International Congress Phytopharm, Mikkeli, Finlandia.
- Gonzalez-Mujica F, Motta N, Márquez AH and Capote-Zulueta J. (2003) Effects of Bauhinia megalandra aqueous leaf extract on intestinal glucose absorption and uptake by enterocyte brush border membrane vesicles. Fitoterapia 74, 84-90.
- González-Mujica F. (2017) Mecanismo de acción de la insulina (Revisión). Vitae Octubre-Diciembre 2017 Nª 72. Disponible en http://vitae.ucv.ve/?module=articulo_pdf&n=5653&rv=137.
- González-Mujica F., Motta N. 2010. Actividad Antihiperglicemiante de Bauhinia megalandra. VITAE- Academia Biomédica Digital. 43, Disponible en: http://vitae.ucv.ve/?module=articulo&rv=95&n=4207.
- Khan A, Ling Z, Pukk K, Herling A, Landau, B and Efendic S. (1998). Effects of 3-mercaptopicolinic acid and a derivative of chlorogenic acid (S-3483) on hepatic and Islet glucose-6-phosphatase activity. Eur. J. Pharmacol. 349: 325-331.
- Marcucci OL, González-Mujica F and Pérez-Ayuso E. (1983). Alteration of liver nuclear envelopes accompanying thioacetamide administration in rats. Acta Cient. Venezolana 34, 109-117.
- Markwell MAK, Hass SM, Bieber LL and Tolbert NE. (1978). A modification of the Lowry procedure to simplify protein determination in membrane and lipoprotein samples. Anal. Biochem. 87, 206-210.
- Nelson DL, and Cox MM. (2005). Lehninger Principles of Biochemistry. Fourth Edition. WH. Freedman and Co. New York.
- Seifter S, Dayton S, Novic B and Muntwyler E. (1950). The estimation of glycogen with the anthrone reagent. Arch. Biochem. 25, 191-200.
- Trinder P. (1969). Determination of glucose in blood using glucose oxidase with an alternative oxygen acceptor. Ann. Clin. Biochem. 6, 24-27.
- Tunnicliffe J, Cowan T, and Shearer J. (2015). Chlorogenic acid in whole body and tissue-specific glucose regulation. Coffee in health and disease prevention. Capítulo 86: 777-786.
- Várkonyi T, Balint GA, Csáti S and Varrò V. (1980). Laboratory method for measuring small amounts of tissue glycogen. Biochem. Exp. Biol. 16: 175-179.
- Werling LL, Brown S and Cox BM. (1984). The sensitivity of opioid receptor types to regulation by sodium and GTP. Neuropeptides.5, 137-40