Diabetes y Obesidad
La obesidad es una de las enfermedades que ha aumentado de manera constante durante las últimas décadas tanto en los países desarrollados como en desarrollo, y presenta pocos signos de desaceleración. Más de 1.500 millones de personas en el mundo tienen sobrepeso o son obesos y más de 40 millones de niños menores de 5 años tienen sobrepeso. La obesidad se asocia con una mayor morbilidad, discapacidad y mortalidad prematura por enfermedad cardiovascular, diabetes, cáncer y trastornos musculoesqueléticos.
La carga económica de esta enfermedad, que es prevenible, plantea una grave amenaza para nuestras sociedades.(1) El aumento de la prevalencia de la obesidad se ha observado en la mayoría de los países, por lo que se considera al sobrepeso y a la obesidad como los causantes de la “epidemia” de diabetes tipo 2.(2)
La obesidad es causada por el desequilibrio que se produce por la alta ingesta y el bajo gasto energético.(3) La Organización Mundial de la Salud (OMS) define a un individuo como obeso cuando su Índice de Masa Corporal (IMC), es igual o superior a 30 kg/m2.
La influencia de la obesidad sobre el riesgo de diabetes tipo 2 se determina no sólo por el grado de obesidad, sino también por el lugar en el cual se almacena la grasa, por esto también se considera signo de obesidad un perímetro abdominal mayor o igual a 102 cm en hombres y en mujeres mayor o igual a 88 cm.
Para Latinoamérica, la Federación Internacional de Diabetes (IDF), recomendó utilizar las medidas de corte de los Sur Asiáticos (≥ 90 cm para hombres y ≥ 80 cm para mujeres) pero ya existen datos disponibles reportados por el Grupo Latinoamericano para el Estudio del Síndrome Metabólico (GLESMO), quien presentó las medidas de corte para Latinoamérica, fundamentadas en un estudio transversal, que relaciona el nivel de grasa intrabdominal con el perímetro abdominal y recomienda que los valores diagnósticos que reflejan el aumento de circunferencia abdominal para nuestra región sean de 90 cm para mujeres y 94 cm para hombres.(4,5,6)
Estudios recientes han identificado “vínculos” entre la obesidad y la diabetes tipo 2 que implica la presencia de citoquinas proinflamatorias (factor de necrosis tumoral α y la interleuquina-6), resistencia a la insulina, trastornos del metabolismo de los ácidos grasos y procesos celulares como la disfunción mitocondrial y el estrés de retículo endoplasmático.
Estas interacciones son complejas y la importancia relativa de cada uno no está claramente definida. Probablemente los estudios genéticos puedan aclarar las vías fisiopatológicas comunes de la obesidad y la diabetes e identificar nuevos objetivos terapéuticos prometedores.(6)
La obesidad(7,8) y la disminución de la actividad física(9) conducen a un estado de resistencia a la insulina y esto, añadido a la carga genética, genera un estado de estrés metabólico que afecta a las células beta del páncreas, aumenta la secreción de insulina para compensar el defecto en la acción de la misma y así mantener en rango normal la concentración de glucosa plasmática.(7,10) Sin embargo, con el tiempo las células comienzan a fallar y en un principio aumenta la concentración postprandial de glucosa y, posteriormente, la concentración en ayunas empieza a aumentar, dando lugar a la aparición manifiesta de la diabetes.
La hiperglucemia y el inadecuado control metabólico derivado de la resistencia a la insulina pueden causar el descenso en el número de células beta, lo que determina la progresión de la enfermedad.(7)
La falta de adaptación de los adipocitos al exceso de nutrientes en la obesidad es causante de la disfunción metabólica. El aumento del tamaño del adipocito y la disfunción del mismo pudieran ser los factores responsables de que la obesidad sea considerada un estado inflamatorio que se conecta con la resistencia a la insulina, quedando la respuesta inmune y la regulación metabólica altamente integradas.(11)
Los efectos celulares deletéreos del exceso de nutrientes inadecuadamente manejados por un adipocito que disfunciona altera señales inflamatorias, aumenta la producción de especie reactivas de oxígeno y genera un caos celular que se caracteriza por estrés del retículo endoplasmático, disfunción mitocondrial, acumulación de triglicéridos, ácidos grasos y activación de serina-treonina proteína quinasas. (Figura 1)
[su_spacer size=”25″]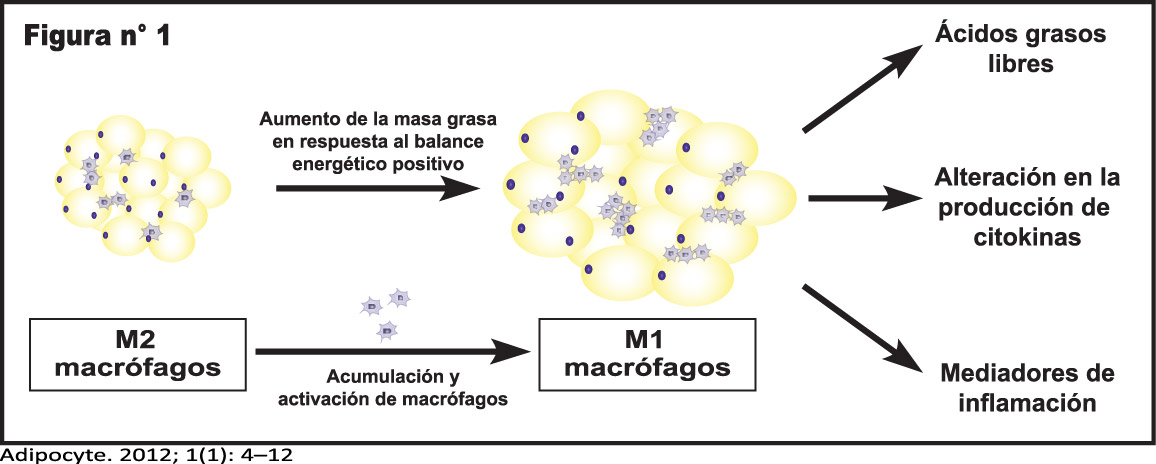 [su_spacer size=”25″]
[su_spacer size=”25″]
La activación de quinasas actúa conectando las señales de insulina a otros factores de crecimiento.(12, 13)
Estas respuestas no son mutuamente excluyentes y la inducción de una puede desencadenar otra. La obesidad se asocia a lesión celular y puede a su vez reclutar y activar macrófagos y otras células inmunes que exacerban la inflamación del tejido.(13, 14)
El tipo de inflamación se conoce como “para-inflamación” y es caracterizada por infiltración de macrófagos en el tejido adiposo blanco, mecanismo involucrado en el auto-mantenimiento de este estado inflamatorio.
La evidencia sugiere que los macrófagos tisulares residentes en el tejido adiposo (ATMs) secretan moléculas bioactivas inflamatorias y citoquinas anti-inflamatorias que podrían estar relacionadas con el desarrollo de bajo grado inflamación sistémica y la resistencia a la insulina.(15, 16)
Los estudios han demostrado que los receptores nucleares son puntos intracelulares de convergencia del metabolismo y la inflamación. Células adiposas disfuncionales producen cambios en los productos secretores lo que aumenta citoquinas inflamatorias y disminuye moléculas que actúan para mejorar la sensibilidad a la insulina.(17) (Figura 2)
[su_spacer size=”25″] 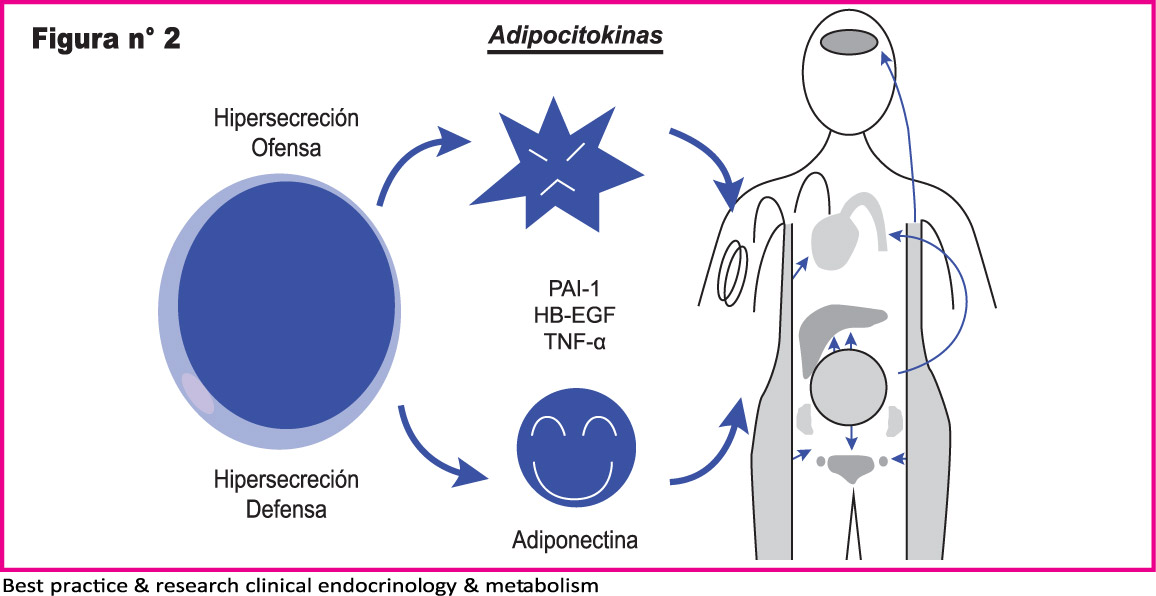 [su_spacer size=”25″]
[su_spacer size=”25″]
Además de la inflamación otro mecanismo que contribuye a la aparición de diabetes en la obesidad es el aumento de los ácidos grasos libres; estos aumentan en respuesta a los adipocitos resistentes al efecto antilipolítico de la insulina,(7, 18, 19) el aumento en forma crónica de los mismos estimula la gluconeogénesis e induce resistencia hepática y muscular además de afectar la secreción de insulina.(20)Estos trastornos inducidos por los ácidos grasos libres se denominan lipotoxicidad.(21, 22)
Cuando la capacidad de almacenamiento de los adipocitos se excede, los lípidos se “desbordan” y comienza la acumulación intramiocelular de lípidos en el músculo y en el hígado proceso que contribuye a la resistencia a la insulina.(23)
Los ácidos grasos que entran en la célula, pueden ser convertidos en triglicéridos, que son inertes en metabolitos de lípidos tóxicos tales como diacilglicerol, ceramida.(24)
Estudios experimentales han demostrado que los análogos de ceramida de cadena corta deterioran la captación de glucosa mediada por insulina al bloquear la translocación del transportador de glucosa GLUT4 a la membrana plasmática.(25, 10) Se ha observado también que la exposición de las células pancreáticas a los ácidos grasos libres pueden causan una marcada inhibición de la expresión de ARNm de insulina, disminución de la liberación de insulina y reducción del contenido de insulina dentro de los islotes.(26) Los pacientes con hiperglucemia son pobremente caracterizados en términos de su historia de obesidad, pero también en la duración de su intolerancia a la glucosa.
Los pacientes con obesidad y normoglicemia ya tienen aumento de la masa y la función de las células beta y cuando presentan leve hiperglucemia ya existe falla de uno de estos mecanismos.
La pérdida inicial de 5% al 10% es inadecuado en el momento del diagnóstico, esto nos hace pensar que lo mejor es iniciar lo más pronto posible la pérdida de peso en nuestros pacientes obesos ya que para el momento en que se presenta hiperglicemia ya hay falla en la función de las células beta del páncreas.(6, 27, 28, 29)
Un problema importante cuando se inicia un régimen dietético como estrategia para la pérdida de peso es la recuperación del mismo, lo que generalmente sigue a cualquier grado de pérdida de peso alcanzado. (Figura 3)
[su_spacer size=”25″]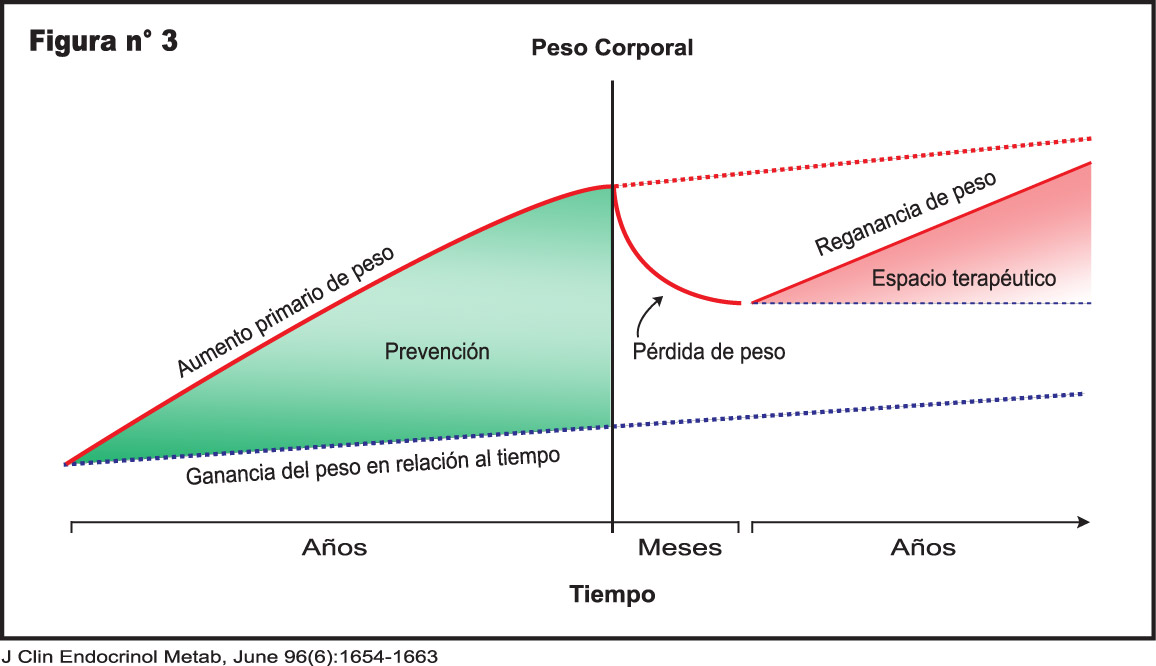 [su_spacer size=”25″]
[su_spacer size=”25″]
Existe una respuesta a la pérdida de peso, en la que participan complejos fisiológicos integrados que son similares a los invocados en la reducción de peso y hacen regresar al individuo a su peso habitual.
La base biológica parece ser la tendencia a defender el peso alcanzado, ya sea normal o excesivo y parecen intervenir múltiples vías de defensa que involucran al sistema nervioso central.
Los modelos actuales de la homeostasis energética predicen defectos genéticos o adquiridos en neurocircuitos claves donde intervienen las señales humorales que determinan la adiposidad. Gran parte de la ciencia básica en esta área ha sido diseñada para modelos animales de obesidad y no ha podido ser extrapolada a los humanos.(6, 30)
La cirugía bariátrica es un procedimiento de elección para lograr clínicamente una pérdida significativa y duradera de peso en personas con obesidad mórbida. La cirugía bariátrica constituye una intervención útil en la resolución o mejora de la severidad de la diabetes tipo 2, aun en personas con sobrepeso. Queda en manos del médico la selección responsable de los pacientes aptos para este procedimiento■(31)
[su_spacer size=”20″] Referencias
-
Nguyen T, Lau DC. The obesity epidemic and its impact on hypertension. Can J Cardiol. 2012 May;28(3):326-33
-
Walls HL, Backholer K, Proietto J, McNeil JJ. Obesity and trends in life expectancy. J Obes. 2012;2012:107989. Epub 2012 May 13
-
Rodgers RJ, Tschöp MH, Wilding JP Dis Model Mech. Anti-obesity drugs: past, present and future 2012 Sep;5(5):621-6
-
Juan Pablo González Rivas. Síndrome metabólico ¿queda espacio para este concepto? Rev Venez Endocrinol Metab 2012; 10(1): 20-27)
-
Aschner P, Buendía R, Brajkovich I, Gonzalez A, Figueredo R, Juarez X, Uriza F, Gómez A, Ponte C. Determination of the cutoff point for waist circumference that establishes the presence of abdominal obesity in Latin American men and women. Diabetes Res Clin Pract 2011;93: 243-247
-
Eckel RH, Kahn SE, Ferrannini E, Goldfine AB, Nathan DM, Schwartz MW, Smith RJ, Smith SR. Obesity and type 2 diabetes: what can be unified and what needs to be individualized? J Clin Endocrinol Metab. 2011 Jun;96(6):1654-63
-
Defronzo RA. Banting Lecture. From the triumvirate to the ominous octet: a new paradigm for the treatment of type 2 diabetes mellitus. Diabetes 2009 Apr;58(4):773-95
-
DeFronzo RA, Soman V, Sherwin RS, Hendler R, Felig P. Insulin binding to monocytes and insulin action in human obesity, starvation, and refeeding. J Clin Invest 1978; 62:204–213
-
Koivisto VA, Yki-Ja¨rvinen M, DeFronzo RA.Physical training and insulin sensitivity. Diabetes Metab Rev 1986; 1:445–481
-
Diamond MP, Thornton K, Connolly-Diamond M, Sherwin RS, DeFronzo RA. Reciprocal variation in insulin-stimulated glucose uptake and pancreatic insulin secretion in women with normal glucose tolerance. J Soc Gynecol Invest 1995;2:708–715
-
Hotamisligil GS. Inflammation and metabolic disorders. Nature. 2006; 444:860–7
-
Summers SA, Garza LA, Zhou H, Birnbaum MJ.Regulation of insulin-stimulated glucose transporter GLUT4 translocation and Akt kinase activity by ceramide. Mol Cell Biol. 1998;18(9):5457–5464
-
Hotamisligil GS, Erbay E. Nutrient sensing and inflammation in metabolic diseases. Nat Rev Immunol 2008; 8:923–934
-
Weisberg SP, McCann D, Desai M, Rosenbaum M, Leibel RL, Ferrante AW Jr. Obesity is associated with macrophage accumulation in adipose tissue. J Clin Invest 2003; 112:1796–1808
-
Hotamisligil GS, Shargill NS, Spiegelman BM. Adipose expression of tumor necrosis factor-alpha:direct role in obesity-linked insulin resistance. Science. 1993; 259:87–91
-
Uysal KT, Wiesbrock SM, Marino MW, Hotamisligil GS. Protection from obesity-induced insulin resistance in mice lacking TNF-alpha function. Nature. 1997; 389:610–4
-
Jacobi D, Stanya KJ, Lee CH. Adipose tissue signaling by nuclear receptors in metabolic complications of obesity. Adipocyte. 2012;1(1):4-12
-
Groop L, Saloranta C, Shank M, Bonadonna RC, Ferrannini E, DeFronzo RA. The role of free fatty acid metabolism in the pathogensis of insulin resistance in obesity and non-insulin dependent diabetes mellitus. J ClinEndocrinol Metab 1991; 72:96–107
-
Fraze E, Donner CC, Swislocki AL, Chiou YA, Chen YD, Reaven GM. Ambient plasma free fatty acid concentrations in noninsulin-dependent diabetes mellitus: evidence for insulin resistance. J Clin Endocrinol Metab 1985;61:807–811
-
Bajaj M, Pratipanawatr T, Berria R, Pratipanawatr W, Kashyap S, Cusi K,Mandarino L, DeFronzo RA. Free fatty acids reduce splanchnic and peripheral glucose uptake in patients with type 2 diabetes. Diabetes2002;51:3043–3048)
-
Unger RH. Lipotoxicity in the pathogenesis of obesity-dependent NIDDM: genetic and clinical implications. Diabetes 1995;44:863–870 , 67
-
Prentki M, Nolan CJ. Islet beta cell failure in type 2 diabetes. J Clin Invest 2006; 116:1802–1812
-
Bays HE, Gonzalez-Campoy JM, Bray GA, Kitabchi AE, Bergman DA, Schorr AB, Rodbard HW, Henry RR. Pathogenic potential of adipose tissue and metabolic consequences of adipocyte hypertrophy and increased visceral adiposity. Expert Rev Cardio Ther 2008;6:343–368
-
DeFronzo RA, Gunnarsson R, Bjorkman O, Olsson M, Wahren J.Effects of insulin on peripheral and splanchnic glucose metabolism in non-insulin-dependent (type II) diabetes mellitus. J Clin Invest 1985;76:149 –155
-
Clin Invest. 2011 November 1; 121(11): 4222–4230, Summers SA, Garza LA, Zhou H, Birnbaum MJ. Regulation of insulin-stimulated glucose transporter GLUT4 translocation and Akt kinase activity by ceramide. Mol Cell Biol. 1998;18(9):5457–5464
-
Higa M, Zhou YT, Ravazzola M, Baetens D, Orci L, Unger RH. Troglitazone prevents mitochondrial alterations, beta cell destruction, and diabetes in obese prediabetic rats. Proc Natl Acad Sci U S A 1999;96:11513–11518
-
Knowler WC, Barrett-Connor E, Fowler SE, et al.; Diabetes Prevention Program Research Group. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med 2002;346:393–403
-
Morgan CL, Jenkins-Jones S, Evans M, Barnett AH, Poole CD, Currie CJ. Weight change in people with type 2 diabetes: secular trends and the impact of alternative antihyperglycaemic drugs. Diabetes Obes Metab. 2012 May;14(5):424-32
-
Look AHEAD Research Group. Long-term effects of a lifestyle intervention on weight and cardiovascular risk factors in individuals with type 2 diabetes mellitus: four-year results of the Look AHEAD trial. Arch Intern Med 2010; 170:1566–1575
-
Eckel RH. Clinical practice. Nonsurgical management of obesity in adults. N Engl J Med 2008;358:1941–1950
-
Demssie YN, Jawaheer J, Farook S, New JP, Syed AA. Metabolic outcomes 1 year after gastric bypass surgery in obese people with type 2 diabetes. Med Princ Pract. 2012;21(2):125-8. Epub 2011 Oct 20.

