Aspectos epidemiológicos, clínicos y de tratamiento con antiveneno igY de huevo de gallina, en el Hospital Universitario de Coro
El envenenamiento ofídico es un problema de salud pública importante mundialmente, tan solo en Latinoamérica se estiman unos 150 mil casos con más de 5 mil muertes al año. En Venezuela se reporta en los últimos diez años entre 4 a 7 mil casos de envenenamientos ofídicos al año con una mortalidad cercana al 2,3% anual. En el hospital Universitario “Dr. Alfredo Van Grieken” de la ciudad de Coro desde el 2021 se viene aplicado un protocolo de tratamiento con antiveneno a base de inmunoglobulinas Y de huevo de gallinas. Se revisaron 152 historias clínicas de pacientes que acudieron al Hospital por presentar envenenamiento ofídico desde septiembre 2021 a diciembre 2022. El 75,6% de los envenenamientos se presentó en el género masculino, la distribución etaria 78,3% adultos y 21,7% menores de 12 años. En el 98% de los casos el género de ofidios con mayor casuística registrada fue Bothrops. La incidencia de severidad fue: leve 53 (34,8%) casos, moderado 43 (28,3%) casos y severo 56 (36,8%), de los cuales a 90 (59,2%) pacientes se le aplico antiveneno IgY. No hubo diferencia en la evolución clínica de los pacientes tratados con antiveneno IgY en comparación con aquellos con antiveneno IgG, del único laboratorio comercial presente en el país. Solo el 2% de los pacientes tratados con IgY presentaron reacción de hipersensibilidad, con síntomas leve. Estos resultados indican que el antiveneno IgY cumple con los criterios de calidad y potencia para su uso en la terapia antiofídica con criterios de eficacia e inocuidad, y representa una alternativa a la terapia con IgG.
PALABRAS CLAVE: Bothrops colombiensis, envenenamiento ofídico, antiveneno IgY, protocolo antiveneno, Venezuela.
INTRODUCCION
Las serpientes, grupo por demás exitoso de los vertebrados, gracias a una gran capacidad de adaptación han ocupado una amplia diversidad de biotopos, de tal manera que las serpientes están presentes en casi todas las latitudes, inclusive en ambientes extremos. Gutiérrez et al. aseguran que estos animales no ven al hombre como su presa y es por eso que su mordedura es considerada un accidente, debido a su intromisión en los terrenos donde habitan las serpientes, por medio de procesos como la deforestación, la siembra, la invasión de su hábitat durante la caza, entre otros (14). Lo anterior hace que este tipo de eventos sea una causa importante de morbilidad y mortalidad humana a nivel mundial. Tan solo en Latinoamérica se estiman unos 150 mil casos y más de 5 mil muertes al año (1, 11).
En el territorio venezolano de acuerdo a los reportes epidemiológicos del Ministerio del Poder Popular para la Salud de los últimos 10 años, han ocurrido entre 4 a 7 mil casos al año, con un promedio de 21,24 accidentes por cada 100 mil habitantes (10, 12, 24, 21). Esta inconsistencia en los numero se relaciona principalmente por un subregistro de casos, además a la disminución de la actividad antrópica en los años 2000 y 2021. Del 80 a 90% de los accidentes ofídicos son del tipo botrópico (Bothrops, Botriechis y Porthidium) (12), son los responsables del mayor número de muertes por envenenamientos debido a la gran agresividad, características de los venenos y vasta distribución geográfica de estos ofidios. Sin embargo, solo seis especies son responsables de la casi totalidad de estos envenenamientos y muertes (12, 2, 24).
El estado Falcon donde se llevó a cabo este ensayo clínico es el 4to estado donde estadísticamente hay mayor incidencia de accidentes ofídicos, principalmente entre los meses de septiembre a noviembre (24). Bothrops colombiensis es la serpiente de mayor incidencia en el ofidismo del estado (12). El hospital Universitario “Dr Alfredo Van Greiken” (HUAVG) es el principal centro de salud del estado y atiende en promedio el 66% de la casuística regional de envenenamientos ofídicos (17).
La terapia antiofídica basada en IgG de origen equino desarrollada por Calmet y Vital Brazil hace más de 100 años (4), ha sido establecido por la Organización Mundial de la Salud (OMS) (27, 23) como el único tratamiento recomendado para neutralizar la acción letal de estos venenos. En Venezuela hay un solo productor de antivenenos, elaborados a partir de suero equino hiperinmune (Biotecfar®-Universidad Central de Venezuela), pero hay un mercado insatisfecho por diferentes razones técnicas. Adicionalmente esta terapia antiofídica a pesar de su evolución y estar en la 4ta generación no ha podido resolver todos los problemas originados por los venenos de serpientes, especialmente los efectos locales que son de rápida instalación (menos de 2 horas) y causan secuelas por necrosis, con pérdida de masa muscular, síndrome compartimental y amputaciones. Adicionalmente inducen reacciones anafilácticas tempranas y tardías relacionadas con la dosis aplicada en los pacientes, alrededor del 11% en los antivenenos faboterápicos (tercera generación [F(ab´) 2] y cuarta generación (Fab)) y más del 20% en los de IgG total (20, 26, 29, 30).
En los últimos años, se ha utilizado cada vez con mayor frecuencia la terapia con inmunoglobulinas IgY de aves, estos anticuerpos aviares en ensayos inmunoquímicos, producción de conjugados y en terapéutica han demostrado un éxito similar al de los anticuerpos en mamíferos (8, 16, 34, 36). Estas moléculas son el equivalente estructural de los fragmentos F(ab) de las IgG (15, 32). Estudios han demostrado que las IgY pueden presentar títulos muy altos con gran especificidad frente al antígeno de interés (37,38), además no activa el sistema de complemento en humanos, por eso su baja reactividad inmunológica (35). Siendo una interesante alternativa las inmunoglobulinas purificadas a partir de huevos de gallinas inmunizadas para su uso como antiveneno ofídico; gracias al bajo costo de producción, gran producción de anticuerpos, su baja reactividad inmunológica y el no maltrato o sacrificio del animal del cual se obtienen (27).
Este proyecto de investigación se realizó con el objetivo de evaluar la eficacia, seguridad y establecer el esquema de tratamiento del antiveneno a base de inmunoglobulinas IgY de gallinas, producido por el laboratorio Labfarsca® en el Hospital Universitario Alfredo Van Grieken de la ciudad de Coro en el estado Falcón, Venezuela.
PACIENTES Y MÉTODO ANTIVENENO
Se utilizó un antiveneno producido por el laboratorio Labfarsca®; consta de 1 frasco vial de 10 ml, polivalente antibotrópico y anticrotálico, liofilizado. Después de reconstituirse el contenido de cada frasco neutralizaba 100 mg de veneno botrópico y 50 mg de veneno crotálico. Las IgY fueron purificadas mediante el protocolo modificado de cloroformo/polietilenglicol (32) de huevos previamente hiperinmunizados con una mezcla de venenos de Bothrops colombiensis, Bothrops venezuelensis y Crotalus durissus cumanensis (mezcla de especímenes juveniles y adultos).
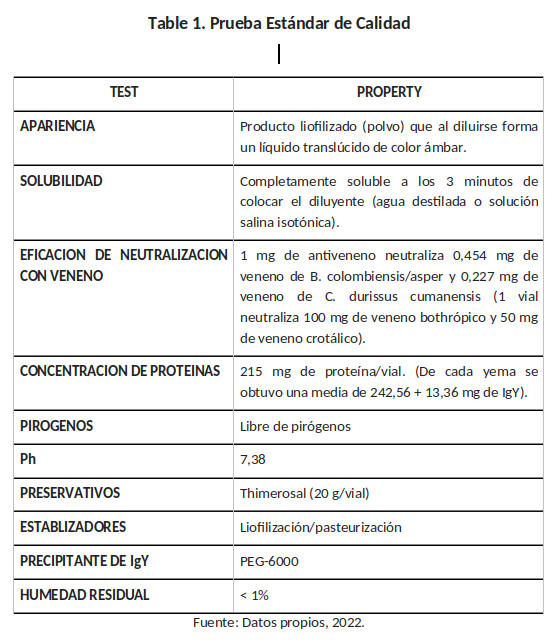
El control del producto final para el aseguramiento de la calidad del antiveneno IgY se resume en la Tabla 1. Los resultados obtenidos indican que el lote de antiveneno evaluado cumple con las especificaciones aprobadas por las normas establecidas por la OMS para antiveneno de uso humano (28).
DATOS CLÍNICOS Y EPIDEMIOLÓGICOS
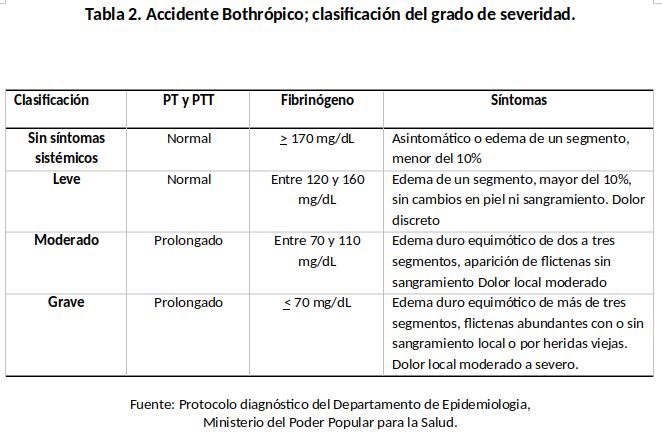
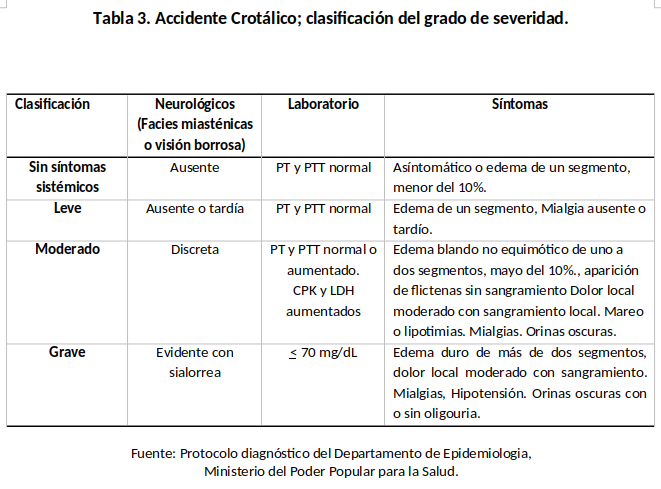
El estudio se diseñó para evaluar la efectividad de antiveneno IgY en los pacientes que ingresaron al Hospital Universitario Alfredo Van Grieken con diagnóstico de envenenamiento ofídico, desde septiembre 2021 a diciembre 2022. A cada paciente (niño/adulto) se le realizó la evaluación clínica y paraclínica en el área de admisión en emergencia, para determinar la naturaleza ofídica del envenenamiento y clasificar el grado de severidad. (tablas 2 y 3). Para cumplir con los requisitos éticos y legales, relacionados con todo trabajo de investigación en todo momento se mantuvo en confidencialidad los datos personales contenidos en la historia médica, recolectándose los antecedentes de importancia que permitieron establecer las características clínicas epidemiológicas de los accidentes ofídicos.
Todo el estudio fue aprobado por la Secretaria de Salud del estado Falcón, y autorizado por el comité de bioética del Hospital Universitario Alfredo Van Grieken. Previo a la colocación del antiveneno, se obtuvo el consentimiento informado firmado de todos los pacientes o de sus familiares en el caso de niños, donde fue explicado por el médico tratante la naturaleza experimental del tratamiento.
Se elaboro una ficha epidemiológica de cada caso, por ser en Venezuela el envenenamiento ofídico una enfermedad de denuncia obligatoria. En el formulario se registraron los siguientes datos: edad, sitio de la mordedura y tiempo transcurrido entre ésta, el ingreso y el comienzo de la terapia antiveneno; atención por la medicina tradicional (torniquetes, bebedizos, inyecciones); tamaño y especie de la serpiente; signos de envenenamiento local y sistémico; resultados de los exámenes hematológicos, de química, clínica e imágenes diagnósticas; pruebas de coagulación y determinación de la concentración de fibrinógeno en el plasma al ingreso, 6, 12, 24 horas post tratamiento y al egreso; dosis del antiveneno; reacciones tempranas adversas; tratamientos complementarios (antibióticos, cirugías, etc.); complicaciones y evolución final.
PROTOCOLO DE TRATAMIENTO
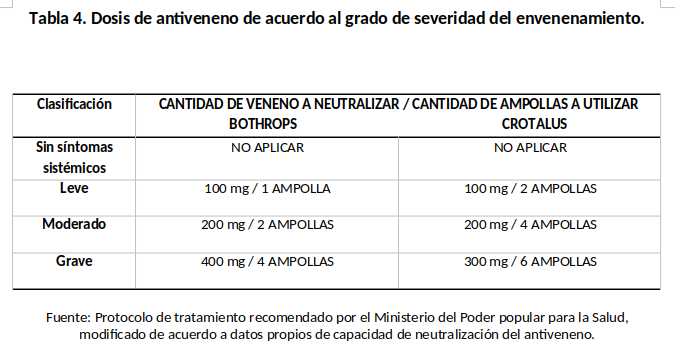
Los pacientes que fueron admitidos en el protocolo de tratamiento se les administro la totalidad de dosis del antiveneno de acuerdo a la clasificación de severidad por infusión IV diluido en 500 ml de solución fisiológica 0.9 normal (niños a razón de 20 ml/Kg. de peso corporal), el cual se pasó en un tiempo de 1 hora. (Tabla 4). En los casos donde se retardaba más de 2 horas en administrar el tratamiento se clasificaba como graves, por los efectos tardíos del veneno. En los niños se usó las mismas cantidades de antiveneno que en el adulto.
No se colocó medicación antialérgica preventivo previa al tratamiento (antihistamínicos o esteroides). En consecuencia, se vigiló estrictamente a todos los pacientes durante 24 horas para evaluar potencialmente reacción contra la IgY durante la inmunoterapia.
Se consideraron como criterios de eficacia de la dosis inicial de antiveneno el cese de la hemorragia local y sistémica en las primeras 6 horas de tratamiento y la normalización de la coagulación sanguínea (pruebas de coagulación y fibrinógeno) durante las primeras 24 horas del tratamiento antiveneno. Si no se lograban esos criterios, se reclasificaba al paciente y se colocaba las dosis de antiveneno adicional correspondiente.
RESULTADOS
Aspectos clínicos y epidemiológicos
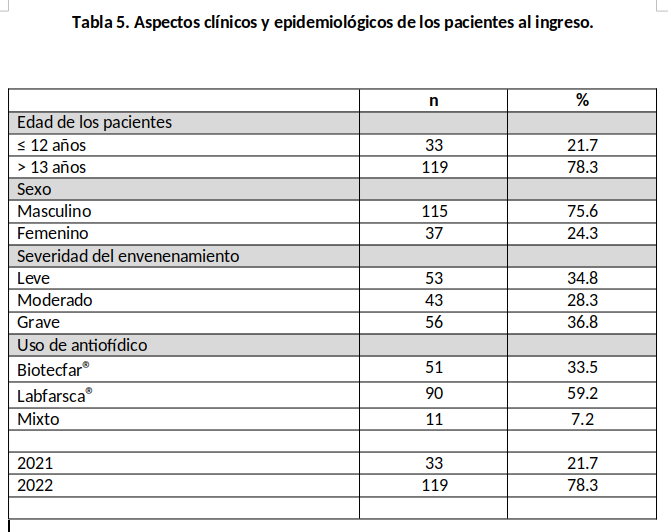
Durante el periodo del estudio se atendieron un total de 152 pacientes con diagnóstico de envenenamiento ofídico; de los cuales 149 de ellos fueron envenenados por serpientes del género Bothrops y tres por Crotalus. Fue más predominante en adultos y en el sexo masculino (Tabla 5). Todos los pacientes tuvieron más de un signo local del envenenamiento; los más frecuente fueron sangramiento por sitio de impronta de los colmillos, edema, flictenas y equimosis en el miembro afectado. El grado final de envenenamiento fue leve quince (34.8%) pacientes, moderado cuarenta y tres (28.3%) pacientes y grave cincuenta y seis (36.8%). Se estimo un tratamiento tardío en aquel paciente que recibió antiveneno pasadas 2 horas del accidente ofídico, de estos 25,6% pacientes fueron atendidos inicialmente por curanderos en sus comunidades, donde recibieron remedios tradicionales. De los pacientes que acudieron al hospital y recibieron tratamiento tardío, veintiséis (17.1%) pacientes fueron reclasificados y se les colocó dosis adicionales de antiveneno. Fallecieron tres pacientes, uno por complicaciones multisistémicas por atención medica posterior a 72 horas sin tratamiento y 2 pacientes con complicaciones por maniobras externas (torniquetes) en miembros inferiores.
Respuesta terapéutica y complicaciones
De los 152 pacientes atendidos, ciento cuarenta y dos (93,4%) pacientes ceso la hemorragia local y el fibrinógeno se normalizó a las 24 horas. Hubo diez (6,6%) recurrencias con coagulopatía sin sangrado posterior a la restauración de la coagulación en las primeras 24 horas, con fibrinógeno normal e INR alto, que se corrigieron en todos los casos con la aplicación de crioprecipitado y plasma fresco. Fallecieron tres pacientes, uno por complicaciones multisistémicas por atención medica posterior a 72 horas sin tratamiento y 2 pacientes con complicaciones por maniobras externas (torniquetes) en miembros inferiores. A noventa (59,2%) pacientes se le coloco exclusivamente antiveneno a base de IgY aviar (Tabla 5). De estos dos (2,2%) pacientes presentaron reacciones de hipersensibilidad (escalofrió y prurito) que se resolvió clínicamente con antihistamínico endovenoso en dosis única. Estos resultados indican que el antiveneno a base de IgY aviar cumple con los criterios de calidad y potencia estándar de neutralización, para su uso en terapia como antiveneno en humanos con criterios de eficacia y seguridad, y representa una alternativa a la terapia con IgG.
DISCUSION
En virtud de la reiterada escasez de antiveneno en el país, la Universidad Nacional Experimental “Francisco de Miranda” (UNEFM) conjuntamente con el Laboratorio LABFARSCA® se planteó el reto de producir un antiveneno polivalente antibotrópico, anticrotálico con base en la tecnología de la IgY de huevos de gallinas. Los protocolos de tratamiento varían para cada país, por ello no se puede generalizar el tratamiento de accidentes ofídicos, muchos se basan en las recomendaciones de los manuales de la Organización Mundial de la Salud, aquel del manual de emergencias toxicológicas de Goldfrank´s, y el método sugerido en el manual de manejo clínico de envenenamientos de Haddad and Winchester’s (22, 40, 41), sin embargo dado que no hay protocolos establecidos de tratamiento del envenenamiento ofídico con antiveneno por IgY pues esta terapéutica es novedosa, nosotros hicimos un protocolo basado en las recomendaciones de la Organización Mundial de la Salud y modificado de acuerdo a las pruebas de neutralización del antiveneno LABFARSCA®-UNEFM frente a los venenos bothropico y crotalicos en ensayos de laboratorio.
La acción procoagulante de los venenos viperidos (botrópico y crotálico), con hipodisfibrinogenemia (disminución de la cantidad y alteración de su función), que se presenta durante el envenenamiento, aunado al daño en la microvasculatura inducido por diferentes fracciones del veneno como las fosfolipasas A2 y metaloproteinasas condiciona el sangrado tanto local como en órganos distantes del sitio de la mordedura, por lo cual en diversos estudios de accidentes ocasionados por estas especies de serpientes, llevados a cabo en américa y en otros continentes (31, 39), se ha concluido que una de las metas del tratamiento con antivenenos es detener en las primeras 6-12 horas el sangrado local y sistémico y normalizar la coagulación sanguínea. Estos criterios son simples y están al alcance de todos los clínicos en todos los lugares, para valorar la eficacia de un antiveneno en accidente por vipéridos.
Los resultados del presente trabajo son similares a los de estudios controlados hechos con antivenenos IgG; con antivenenos F(ab’)2, producidos en Brasil (Instituto Butantán), y de IgG total producidos en Costa Rica (Instituto Clodomiro Picado) y Colombia (Instituto Nacional de Salud) (7, 9, 19) puesto que en nuestro ensayo casi todos los pacientes (93,4%) detuvieron el sangrado local y sistémico en las primeras 6-12 horas, y se normalizó la coagulación en las primeras 24 horas.
El hallazgo de la persistencia de alteración del INR en el 6% de los pacientes con hipoprotrombinemia con concentraciones normales de fibrinógeno a las 24 horas después del tratamiento con antiveneno ha sido descrito por otros autores (6, 18, 24, 31, 33, 39). Este fenómeno es común dado que en el proceso de inoculación de los pools de venenos para la hiperinmunizacion de los animales (caballos, gallinas) se usa un número reducido de venenos, en algunos casos estos tienen baja potencia neutralizante de fracciones activadoras de la protrombina, en comparación con su alta actividad frente a otros componentes del veneno. También hay que tomar en cuenta la respuesta idiosincrática del paciente frente al envenenamiento ofídico, dado que en la historia clínica aun cuando se explora sus antecedentes y enfermedades concomitantes, estas no son extensamente evaluadas durante la atención en la emergencia y colocación del antiveneno. De allí que en el ensayo clínico se opto por corregir los factores de coagulación con crioprecipitado y plasma fresco y no con antiveneno adicional.
A pesar de las innovaciones tecnológicas introducidas en la producción de los antivenenos faboterapicos (F(ab) y F(ab 2 ), no se ha logrado eliminar las reacciones de hipersensibilidad tempranas y tardías con el uso de antivenenos de origen IgG, por activación del complemento, lo cual en algunos casos puede poner en riesgo la vida del paciente. Aun cuando la IgY no activa el sistema de complemento, si está documentado en pacientes la hipersensibilidad a la albumina y otros componentes mayores del huevo, lo cual es más común en los niños (0,5-2% de la población pediátrica) (3. 5, 13, 35).
Las recomendaciones de la guía de la Organización Mundial de la Salud sobre perfiles de productos para tratamientos de mordeduras de serpiente, con el fin de mejorar la calidad de los antídotos disponibles en el mercado, recomienda que los antivenenos deben tener una incidencia de la anafilaxia menor al 5,0% (40), aun cuando es temprano para sacar una conclusión durante el tratamiento solo el 2% de los pacientes tratados con IgY presentaron reacción de hipersensibilidad, con síntomas leve.
La atención medica tardía (más de 2 horas después de ocurrido el envenenamiento) sigue siendo un problema de salud pública importante, el veneno se puede difundir a un tercer espacio (depósitos tisulares y sistema linfático) de tal manera que finalmente la concentración sérica de antiveneno es insuficiente para neutralizarlo todo, donde se observa mejoría parcial y la recurrencia de los signos de envenenamiento: hemorragia, edema, coagulopatías, que pueden complicar aún más una patología medica compleja como es el envenenamiento ofídico. En este estudio en el 17.1% de los pacientes hubo que reclasificar y colocar antiveneno adicional por tratamiento tardío, lo cual aumenta los costos de tratamiento y prolonga el tiempo de hospitalización.
Esta problemática no es exclusiva de nuestra región, por eso los accidentes por animales venenosos, especialmente las mordeduras de serpientes, fueron incluidos por la OMS en la lista de Enfermedades Tropicales Desatendidas pues afectan con mayor frecuencia a las poblaciones pobres que viven en zonas rurales, desencadenando discriminación, abandono, pérdida de ingresos, problemas de salud mental, reducción de la calidad de vida y muertes (28).
Siguiendo los objetivos planteados por la Red de Laboratorios Públicos Productores de Antivenenos (RELAP) en el 2018 bajo la coordinación de PANAFTOSA/SPV-OPS/OMS, de ampliar la disponibilidad y accesibilidad de antivenenos eficaces y seguros, para lograr la reducción de la morbilidad y la mortalidad de los accidentes ofídicos en las Américas, nosotros planteamos hacer ensayos multicéntricos a fin de demostrar la efectividad del antiveneno IgY en diferentes escenarios médicos.
AGRADECIMIENTOS
Lo autores agradecen al personal del hospital Universitario Alfredo Van Greiken donde se realizó el estudio, y a la Secretaria de Salud del Estado Falcón por el apoyo logístico y financiero para la investigación, y declaramos no tener ningún conflicto de intereses.
Referencias Bibliográficas
Bermúdez FJ. Caracterización epidemiológica de los accidentes ofídicos, en pacientes pediátricos, Cartagena de Indias 2006-2007. Rev. Cienc. Biomed. 2010;1(1):23-9.
Boadas J, Matos M, Bónoli S, Borges A, Vásquez-Suárez A, Serrano L, et al. Perfil eco-epidemiológico de los accidentes por ofidios en Monagas, Venezuela. (2002-2006). Bol. Mal. Salud Amb. 2012;52(1):107-20.
Bock SA. Prospective appraisal of complaints of adverse reactions to foods in children during the first 3 years of life. Pediatrics 1987; 79:683-688.
Bon C. The serum-therapy was discovered 100 years ago. Toxicon 1996; 34: 142-143.
Boyano-Martínez T, García-Ara C, Díaz-Pena JM, Martín- Esteban M. Prediction of tolerance on the basis of quantification of egg white-specific IgE antibodies in children with egg allergy. J Allergy Clin Immunol 2002; 110:304-309.
Boyer LV, Seifert SA, Cain JS. Recurrence phenomena after immunoglobulin therapy for snake envenomations: Part 2. Guidelines for clinical management with crotaline Fab antivenom. Ann Emerg Med 2001; 37: 196-201.
Cardoso JLC, Fan HW, França FOS, Jorge MT, Leite SA, Nishioka SA, et al. Randomized comparative trial of three antivenoms in the treatment of envenoming by lance-headed vipers (Bothrops jararaca) in São Paulo, Brazil. Q J Med 1993; 56: 315-325. 2.
Carmen E. Alarcón. Hernán Hurtado, Jaime E. Castellanos. REVlSlON DE TEMA. Anticuerpos aviares: alternativa en producción y diagnóstico. Biomédica 2000, 20: 338-43.
Chippaux JP, Lang J, Eddinc SA, Fagot P, Rage V, Peyrieux JC, et al. Clinical safety of a polyvalent F(ab´) 2 equine antivenom in 223 African snake envenomations: a field trial in Cameroon. VAO (Venin Afrique de l´Ouest) Investigators. Trans R Soc Trop Med Hyg 1998; 92: 657-662.
Ferro Gloria, Al Troudy Milad, Scott Duglas, Castillo-Gagliardi David, Castillo Trujillo David J. Caracterización epidemiológica del accidente ofídico, Municipio Gran Sabana del Estado Bolívar – Venezuela. GICOS: Revista del Grupo de Investigaciones en Comunidad y Salud, ISSN-e 2610-797X, Vol. 1, Nº. 1, 2016.
Faire face à la charge de mortalité et de morbidité due aux envenimations par morsures de serpents. Soixante et Onzième Assemblée Mondiale de la Santé. Point 12.1 de l’ordre du jour WHA71.5. 26 mai 2018.
González, Carlos; Madriz, Yoglan; Villegas, Dalwin. Cuad. Esc. Salud Pública; (69): 3-9, ene.-abr. 2002. Estudio clínico-epidemiológico del emponzoñamiento ofídico en la costa oriental del estado Falcón 1998-2001
Góngora-Meléndez MA, Magaña-Cobos A, Montiel-Herrera JM, Pantoja-Minguela CL y col. Alergia a las proteínas del huevo en edad pediátrica. Revista Alergia México2015; 62:234-250.
Gutierrez MJ, Williams D, Fan HW, Warrell DA. Snakebite envenoming from a global perspective: Towards an integrated approach. Toxicon 2010;56(7):1223-35.
Hädge, D. & Ambrosius, H. Evolution of low molecular weight immunoglobulins. IV. Ig Y-like immunoglobulins of birds, reptiles and amphibians. Precursors of mammalian Ig A. Molecular Immunology1984; 21, 699-707.
Hansen Wilber Murcia Gutierrez. Importancia de las inmunoglobulinas aviares y sus aplicaciones en inmunoensayos. Teoría y Praxis Investigativa Julio-Diciembre 2009; Volumen 4 – No. 2, Centro de Investigación y Desarrollo-CID / Fundación Universitaria de Área Andina.
Hospital Universitario Dr. Alfredo Van Greiken. Datos Estadísticos; Morbilidad de Emponzoñamiento Ofidio Según Municipio Año 2017-2021. Servicio de Epidemiologia; 2021.
Laustsen, A.H., Gutiérrez, J.M., Knudsen, C., Johansen, K.H., Bermúdez-M, E., Cerni, F.A., Jürgensen, J.A., Ledsgaard, L., Martos-Esteban, A.,Øhlenschlæger, M., Pus, U., Andersen, M.R., Lomonte, B., Engmark, M., Pucca, M.B., 2018a.Pros and cons of different therapeutic antibody formats for recombinant antivenom development. Toxicon 146, 151–175. https://doi.org/10.1016/j.toxicon.2018.03.004.
León G, Mongue M, Rojas E, Lomonte B, Gutiérrez JM. Comparison between IgG and F(ab’)2 polyvalent antivenoms: neutralization of systemic effects induced by Bothrops asper venom in mice, extravasation to muscle tissue, and potential for induction of adverse reactions. Toxicon 2001; 39: 793-801.
León G, Valverde Jm, Rojas G, Lomonte B, Gutiérrez JM. Comparative study on the ability of IgG and F(ab) sheep antivenoms to neutralize local hemorrhage, edema and myonecrosis induced by Bothrops asper (terciopelo) snake venom. Toxicon 2000; 38: 233-244.
Leonardo De Sousa, Jessica BC, Mercedes Matos, Stefano Bónoli, Belsy Guerrero, Alexis R-A. Epidemiología del ofidismo en Venezuela (1996-2004). Invest. clín jun. 2013; vol.54 no.2.
Lorenzo MP, Hernández RM, Soria MI. Cuidados de Enfermería en el Accidente Ofídico en España. ENE. Revista de Enfermería. 2012;7(1).
Manuela B. Pucc, Felipe A. Cerni, Rahel Janke, Erick Bermúdez-Méndez. History of Envenoming Therapy and Current Perspectives. REVIEW. Frontiers in Immunology | www.frontiersin.org 1 July 2019 | Volume 10 | Article 1598
Masci PP, Mirtschin PJ, Nias TN, Turnbull RK, Kuchel TR, Whitaker AN. Brown snakes (Pseudonaja genus): venom yields, prothrombin activator neutralization and implications affecting antivenom usage. Anaesth Intensive Care 1998; 26: 276-281.
Ministerio de Sanidad y Asistencia Social. Anuario de Epidemiologia y Estadística Vital. División de Enfermedades Transmisible y Accidentes. Departamento de Vigilancia Epidemiológica; 2000-2022.
Morais JF, De Freitas MCW, Yamaguchi IK, Dos Santos MC, Dias Da Silva WD. Snake antivenoms from hyperimmunized horses: comparison of the antivenom activity and biological properties of their whole IgG and F(ab´) 2 fragments. Toxicon 1994; 32: 725-734.
Navarro, D., Vargas, M., Herrera, M., Segura, Á., Gómez, A., Villalta, M., Ramírez, N., Williams, D., Gutiérrez, J.M., León, G., 2016. Development of a chicken-derived antivenom against the taipan snake (Oxyuranus scutellatus) venom and comparison with an equine antivenom. Toxicon 120, 1–8. https://doi.org/10.1016/j.toxicon.2016.06.018.
Organización Mundial de la Salud. Guía para la producción, control y regulación de inmunoglobulinas de antiveneno de serpientes. WHO 67th technical reports; 2017.
Otero-Patiño, R., Segura, Á., Herrera, M., Angulo, Y., León, G., Gutiérrez, J.M., Barona, J., Estrada, S., Pereañez, A., Quintana, J.C., Vargas, L.J., Gómez, J.P., Díaz, A., Suárez, A.M., Fernández, J., Ramírez, P., Fabra, P., Perea, M., Fernández, D., Arroyo, Y., Betancur, D., Pupo, Lady, Córdoba, E.A., Ramírez, C.E., Arrieta, A.B., Rivero, A., Mosquera, D.C., Conrado, N.L., Ortiz, R., 2012. Comparative study of the efficacy and safety of two polyvalent, caprylic acid fractionated [IgG and F(ab’)2] antivenoms, in Bothrops asper bites in Colombia. Toxicon 59, 344–355. https://doi.org/10.1016/j.toxicon.2011.11.017.
Otero R, Gutiérrez JM, Rojas G, Núñez V, Díaz A, Miranda E, et al. A randomized blind clinical trial of two antivenoms prepared by caprylic acid or ammonium sulphate fractionation of IgG, in Bothrops and Porthidium snake bites in Colombia. Correlation between safety and biochemical characteristics of antivenoms. Toxicon 1999; 37: 895-908.
Otero R, Núñez V, Barona J, Díaz A, Saldarriaga M. Características bioquímicas y capacidad neutralizante de cuatro antivenenos polivalentes frente a los efectos farmacológicos y enzimáticos del veneno de Bothrops asper y Porthidium nasutumde Antioquia y Chocó. Iatreia 2002; 15: 5 -15.
Polson, A. 1990. Isolation of IgY from the yolk of eggs by a chloroform-polyethylene glycol procedure. Immunol. Invest.19: 253-258.
Rafael Otero Patiño et al. Accidente botrópico en Colombia: estudio multicéntrico de la eficacia y seguridad de Antivipmyn-Tri®, un antiveneno polivalente producido en México. IATREIA 2007; vol 20, no. 3: septiembre.
Rahman, S., Van Nguyen, S., Icatlo, F. C. Jr., Umeda, K. & Kodama, Y. (2013). Oral passive IgY-based immunotherapeutics. Human Vaccines & Immunotherapeutics 9, 1039–1048.
Savage JH, Matsui EC, Skripak JM, Wood RA. The natural history of egg allergy. J Allergy Clin Immunol 2007; 120:1413- 1417.
Shin, N. R., Choi, I. S., Kim, J. M., Hur, W. & Yoo, H. S. Effective methods for the production of immunoglobulin Y using immunogens of Bordetella bronchiseptica, Pasteurella multocida and Actinobacillus pleuropneumoniae. Journal of Veterinary Science2002; 3, 47-57.
Shin J. H., Roe, I. H. & Kim, H. G. Production of anti-Helicobacter pylori urease-specific immunoglobulin in egg yolk using an antigenic epitope of H. pylori urease. Journal of Medical Microbiology2004; 53, 31-34.
Sun, S., Mo, W., Ji, Y. & Liu, S. Preparation and mass spectrometric study of egg yolk antibody against rabies virus. Rapid Communication. Mass Spectrometry2001; 15, 708-712.
Talita Bavaresco, Maira Alana Hollmann, Thiago Fucuta de Moraes, Fernanda C-S, Carla Brugin Marek. Acidente ofídico grave atendida em um hospital escola – Relato de caso 6to Congresso de Ciencias farmacéuticas do Mercosul. Noviembre 2016.
Word Health Organization. Guidelines for the management of snakebites, 2nd edition ISBN 978-92-9022.530.0. 2016.
Warrell DA. Venomous Bites, Stings, and Poisoning. Infect Dis Clin North Am. 2012; 26(2):207-23.
Autores
Rengifo G. Cesar 1,3
Bremo Adolfo 1,3
Yrausquin Jose 3
Duno Angel 2,3
Reyes Imelda 1
Bello Alfredo 3
Guerra Uslar 2
Programa de Medicina, Ciencias de la Salud, UNEFM
Programa de Ciencias Veterinarias, Ciencias del Agro y del Mar, UNEFM
Centro de investigaciones tecnológicas (CITEC), UNEFM

