Concordancia entre los observadores para la determinación cualitativa de los anticuerpos anti-nucleares y anti-ADN
Resumen
Un sistema de control de calidad permanente en un laboratorio es importante debido a que da seguridad a tanto al médico como al bioanalista en relación a los resultados obtenidos de las pruebas solicitadas. Uno de los elementos a tomar en cuenta es el grado de concordancia interobservador para evaluar las causas de variación y corregirlas. El presente trabajo trata de evaluar el grado de concordancia interobservador para la determinación de anticuerpos-antinucleares y anti-ADN en el Laboratorio de Reumatología(HUC). El AAN se determinó por Inmunofluorescencia indirecta utilizando láminas Hep-2. El Anti-ADN se determinó por el método de inmunofluorescencia indirecta de la Crithida lucillae. Cuatro bioanalistas evaluaron 48 muestras de forma independiente y ciega a los resultados de los otros bioanalistas, utilizando 7 categorías para AAN y 2 categorías para anti-ADN. Se determinó Kappa ponderada con límite inferior de confianza del 95% utilizando el programa PC-agree de la Universidad de McMaster (Canadá). Obteniéndose para AAN una Kappa significativa (Kappa=1,0) en los patrones Nucleolar y Centrómero. El patrón difuso-periférico (K=0,25), presentó el valor más bajo. Para el anti-ADN se obtuvo una Kappa de 0,98 en positividad y negatividad. Se demostró que en Laboratorio existe una alta concordancia entre bioanalistas para la determinación de AAN y anti-ADN, así como también que el patrón difuso-periférico es poco confiable.
Introducción
Desde el año 1982 viene funcionando el laboratorio de la Unidad de Reumatología del HUC, adscrito al Centro Nacional de Enfermedades Reumáticas. Este laboratorio, centro de referencia de los otros laboratorios ubicados en 8 de las unidades de reumatología a nivel nacional, tiene como uno de sus objetivos básicos el entrenamiento de personal calificado para la realización de pruebas inmuno-reumatológicas que son de vital importancia para el diagnóstico y seguimiento de los pacientes con enfermedades autoinmunes. En él, se han venido desarrollando y estandarizando, conjuntamente con el laboratorio de investigación del Centro Nacional de Enfermedades Reumáticas, 1as técnicas necesarias para la medición de las siguientes pruebas: anticuerpos anti-nucleares, anticuerpos anti-ADN, anti-Ro, anti-La, anti-Sm, anti-RNP, factor reumatoide cualitativo, complemento hemolítico total y sus fracciones como C3 y C4, crioglobulinas y anti-fosfolípidos, entre otros. En la actualidad este laboratorio procesa un promedio de 600 pruebas inmunológicas mensuales.
Un sistema permanente de control de calidad, se mantiene en este laboratorio; el cual le da seguridad al médico y al bioanalista en relación a los resultados obtenidos de las pruebas solicitadas. Para esto, es necesario tener siempre en cuenta los siguientes elementos:
- conocer el grado de concordancia entre el personal que realiza las pruebas, para evaluar las causas de variación y corregir las mismas.
- revisar periódicamente los patrones de referencia,
- realizar el mantenimiento adecuado de los equipos y
- utilizar reactivos de buena calidad (1).
En el presente reporte, se evalúa el grado de concordancia interobservador para la determinación de anticuerpos antinucleares (AAN) (tipo de patrón e intensidad de la fluorescencia) y el anti-ADN (positividad e intensidad de la fluorescencia).
Materiales y Métodos
El AAN se determinó mediante la técnica de inmunofluorescencia indirecta, que consiste en la utilización de láminas comerciales con células Hep-2 como sustrato fijadas en pozos(2). Los sueros de los pacientes fueron diluidos 1 en 30 con buffer fosfato salino (PBS), se colocaron en los pozos y fueron incubados por 45 minutos a temperatura ambiente (f.A.) Cada lámina fue lavada 3 veces con PBS para remover el exceso de suero; y una vez completado este paso, se colocaron en cada pozo el conjugado de fluoresceina (FITC) durante 30 minutos, seguido de 3 lavados más con PBS. Finalmente, se montaron las láminas con glicerina-PES al 50% y fueron leídas en un microscopio de inmunofluorescencia (Zeiss, Standard Lab, Paragon, Caracas, Venezuela). Controles positivos y negativos fueron montados en cada corrida y los resultados se reportaron de acuerdo al patrón e intensidad de la fluorescencia. El anti-ADN se determinó de acuerdo al método de inmunofluorescencia indirecta de la Crithidia Lucillae. La técnica seguida es similar a la descrita para las AAN con algunas variantes(3-6). Los resultados fueron reportados en relación a la positividad e intensidad de la fluorescencia.
Cuatro bioanalistas evaluaron cada una de las muestras de forma independiente y ciega a los resultados de las otras bioanalistas.
Para la determinación del patrón del AAN se utilizaron 7 categorías: moteado, anti-centrómero, difuso, nucleolar, periférico, negativo y la combinación de difuso-periférico. Para la cuantificación del grado de fluorescencia se utilizaron 5 categorías: negativo y en cruces de una a cuatro. Para la determinación del anti-ADN se utilizaron 2 categorías para su presencia: positivo, negativo y para los títulos las mismas categorías usadas para el AAN.
Se utilizaron 48 muestras para la determinación del grado de concordancia para el AAN y anti-ADN, lo cual permitía comparar dos kappas(7) utilizando 4 categorías. Se determinó Kappa ponderada con pesos cuadráticos utilizando para ello el programa “PC-agree” de la Universidad de McMaster (Harnilton, Ontario, Canadá) y su límite inferior de confianza del 95% (7,8).
Resultados
AAN:
De los 7 patrones reportados el anti-centrómero y nucleolar (Kappa= 1,0) fueron los más significativos, representando el máximo de concordancia entre observadores. No obstante, exceptuando el patrón combinado di fusa-periférico (Kappa= 0,25) que fue el valor más bajo, los otros valores mostraron una concordancia superior a 0,71 (Tabla 1).
[su_spacer size=”30″]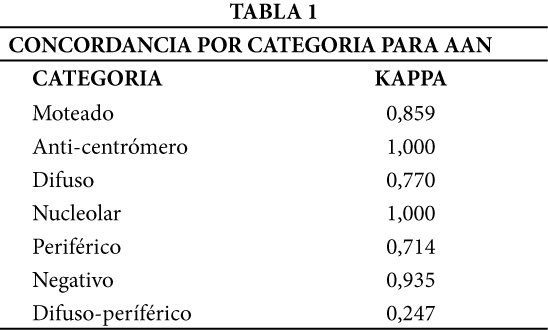 [su_spacer size=”30″]
[su_spacer size=”30″]
Los resultados en relación al título (Tabla 2), reportaron el acuerdo más bajo para las dos cruces de inmunofluorescencia (Kappa= 0,47) y el más alto para la categoría de negativo (Kappa = 0,96). El patrón cuatro cruces fue la más alta concordancia entre los positivos, indicando una alta relación entre los observadores para el reporte de este patrón.
[su_spacer size=”30″]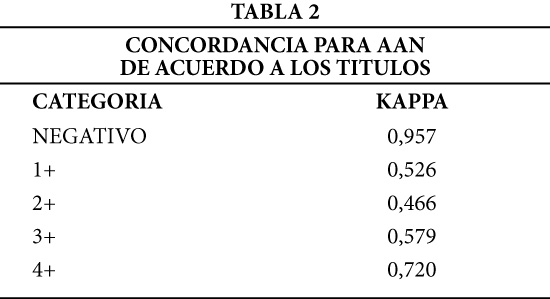 [su_spacer size=”30″]
[su_spacer size=”30″]
En la Tabla 3 se presenta la Kappa global para el patrón y el título del AAN, observándose en ambos casos una alta concordancia, considerada excelente para título (0,91) y muy buena para patrones (0,86). Los intervalos de confianza (IC) inferiores, son superiores a 0,75 para ambos, lo cual indica que la verdadera concordancia nunca es menor a un nivel establecido como bueno (1).
[su_spacer size=”30″]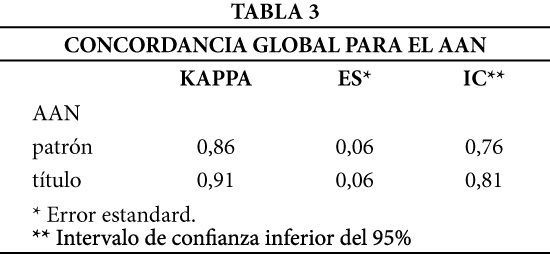 [su_spacer size=”30″]
[su_spacer size=”30″]
ANTI-ADN
El acuerdo para la categoría de positividad o negatividad fue de K=0,98 considerada excelente (no mostrada).
La Tabla 4 muestra un valor Kappa de 0,98 para la categoría de negativo en relación al título para anti-ADN. Los valores extremos de positividad (1+ y 4+) presentaron los acuerdos más bajos (K=0,21 y 0,50 respectivamente). Sin embargo, observando la concordancia global para el título, éste fue de K=0,97 (Tabla 5) considerado excelente al igual a lo descrito para AAN.
[su_spacer size=”30″]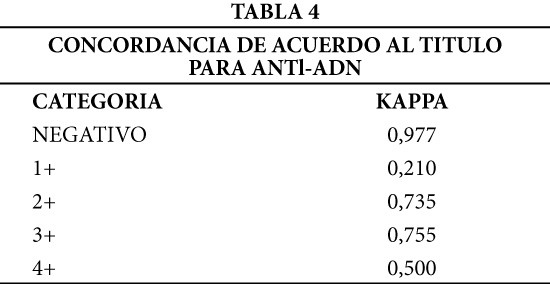 [su_spacer size=”30″]
[su_spacer size=”30″]
[su_spacer size=”30″]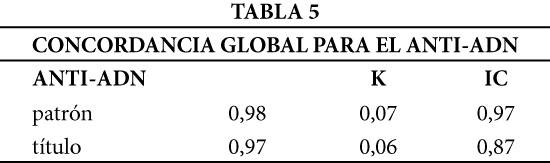 [su_spacer size=”30″]
[su_spacer size=”30″]
Para analizar si los mejores acuerdos obtenidos con los patronos para AAN y títulos de ADN están relacionados con la frecuencia de estas categorías, se construyeron tablas de contingencia (no mostradas).
Los patrones para AAN, anti-centrómero y nucleolar, fueron reportados con una frecuencia total de 8, no mostrando diferencia estadísticamente significante en relación con los otros patrones (p=1,0). En ambos casos el acuerdo fue excelente (Kappa=1,0). Por otro lado, aunque el patrón difuso-periférico fue reportado en 5 casos mostró un pobre acuerdo (Kappa=0,247) entre observadores.
En relación a la frecuencia de los títulos de ADN reportados, los de 1+ fueron reportados en solo 3 ocasiones, no mostrando diferencia estadísticamente significante con respecto a los otros títulos (p=0,85).
Discusión
Las evaluaciones de los servicios de salud, incluyen las evaluaciones del proceso, y dentro de éstos se incluyen los llamados estudio de control de calidad, en los cuales el principal objetivo es evaluar el grado de concordancia o consistencia en los resultados entre las personas que realizan una determinada prueba (bioquímica, inmunológica o hematológica, etc.), para identificar las causas de la variación y corregir las mismas (1).
El presente estudio representa solo uno de los aspectos del control de calidad que se lleva en nuestro laboratorio de reumatología, en el cual se demostró que en el mismo existe una alta concordancia entre bioanalistas para la determinación de anticuerpos anti-nucleares y anti-ADN confiriéndoles un mayor grado de confiabilidad al médico en la interpretación de dichos exámenes, independientemente de la finalidad por la cual se pidieron (diagnóstico, control, actividad y pronóstico). Utilizando la misma metodología, demostramos que el patrón difusa-periférico es poco confiable por el pobre acuerdo existente entre observadores. Esto puede obedecer a la dificultad en determinar la existencia de un solo patrón cuando coexisten dos patrones con igual grado de inmunofluorescencia o a la poca dilución del suero. Este aspecto necesita ser investigado posteriormente.
En publicaciones previas se ha reportado una buena concordancia entre dos laboratorios para medir ADN(9), a pesar de utilizar dos técnicas diferentes. La concordancia estimada utilizando la Kappa no ponderada de la tabla 2(9) da tm valor de 0,92 y en nuestro caso de 0,98.
El punto que permite diferenciar 1+ a la negatividad es difícil de precisar en el caso de ADN, por tanto se debe considerar como positivos los que presentan más de 2 cruces.
La frecuencia de reportes en cada una de las categorías así como el desbalance en los totales de las tablas de contingencia pudiera influir en la concordancia inter observadores, a pesar de parecer alta la concordancia, aunque esta paradoja de los valores de kappa han sido publicados en relación a la concordancia medida en una tabla de 2 x 2 (10-11)
Referencias
- Feinstein A. Chapter 4: An Outlione of Cause-Effect Evaluations en: Feinstein A. Clinical Epidemiology: The Architecture of Clinical Research. W.B. Saunders Company: Toronto, 1985.
- Beck, K. Variations ion the Morphological Patterns of Autoinmune Nuclear Fluorescence. Lancet, 1961, 1: 1201.
- Aarde L, De Groot E, fetkamp t. Inmunology of DNA. III. Chrithidia Luciliae, A Simple Sustrate for the Determination of anti-ds-DNA with the immunofluorescence Technique. Ann. N.Y. Acad. Sci., 1975,254: 505.
- Stingle G, Meingassner J, Swelty P, Kanpp W. An Immunoflorescence Procedure for the Demostration of Antibodies to Native, Double Stranded DNA and of Circulating DNA-anti-DNA complexes. Clin. immunol. and Inmunopathol. 1976,6: 131-140.
- Sontheimer4 R, Guilliam J. An Inmunoflorescence Assay for Double-Straded DNA Antibodies Using the Crithidia Luciliae Kinetopast as Double-Stranded DNA Substrate. J. Lab. and Clin. Mled. 1978,91 ( 4): 550-558.
- Crowe W. KushnerI. An Immunofluorrescent Methods Using Crithidia Lucilia to Detect Antibodies to Double-Stranded DNA. Arthritis and Rhem. 1977,20 (3): 811-814.
- Kramier, M.S., Feinstein, A.R.: Clinical Biostatics LIV. The Biostatics of concordance. Phrmacol. Ther. 29:111-123, 1981.
- Fleiss J. Statistical Methods for rates and Proportions. Second Edition. Toronto: John Wiley & Sons, 1981.
- Feigenbaum P, Medsger T, Kranines G, Fties J. The Vatiability of Immunologic Laboratory Tests. J. Re hum. 1982, 9 (1): 408-414. 58
- Feinstein A. Cicchetti D. High Agreement but Low Kappa: I. The Problems of Two Paradoxes. J. Clin. Epdi. 1990, 43 (6): 543-549.
- Cicchetii D, Feinsteion A. High Agreement but low Kappa: II Resolving the Paradoxes. J. Clion. epid. 1990, 43 (6): 551-558.

