Amibiasis
La amibiasis o entamobiosis, es una parasitosis producida por el protozoario Entamoeba histolytica (Sarcodina: Amoebida). Es una infección cosmopolita, asociada con insalubridad, condiciones de higiene precaria o ausente, fecalismo y coprofagía directa, ésta última la más común en pacientes psiquiátricos. Aunque afecta principalmente a niños y adultos jóvenes, los grupos de mayor riesgo son los habitantes de zonas que no cuentan con los servicios adecuados para establecer condiciones mínimas de salubridad, como agua potable y sistemas de drenaje entre otros, encontrándose mayormente afectados los países en vías de desarrollo. Igualmente, favorecen la transmisión, determinadas costumbres relacionadas con hábitos higiénicos deficientes y manejo inadecuado de alimentos. La infección también es frecuente entre homosexuales y heterosexuales que practican contacto ano-oral. La amibiasis genera más de 100 millones de muertes anuales (WHO, 1997; Haque 2006). Es la segunda causa de muerte producida por protozoarios, después de la malaria (WHO, 1997).
Algo de historia
Esta enfermedad fue descrita por primera vez en el siglo V por Hipócrates a lo que llamó “enfermedad ulcerativa intestinal” en su trabajo “De las Epidemias” refiriéndose a la disentería y a diferentes variantes de esta patología, las relacionó con el consumo de aguas insalubres en temporada veraniega.
Sin embargo, la clasificación del parásito corresponde a Lambl (1824-1895), quien en 1860 publicó la identificación microscópica de un microorganismo observado en las heces de un niño de Praga, que padecía la denominada diarrea infantil. Para 1883 Koch identificó amibas en cinco casos de abscesos hepáticos provenientes de Egipto y tres años después Kartulis las observó en 150 casos de amibiasis intestinal en el mismo país. Sin embargo, no es sino hasta el año de 1891 que dos patólogos norteamericanos, Councilman y LaFleur, estudiaron 14 casos de autopsia, describieron con gran claridad las lesiones y concluyeron que la disentería amebiana es una identidad bien definida caracterizando como agente etiológico a Entamoeba histolytica.
Aspectos biológicos
A lo largo de su ontogenia, Entamoeba histolytica exhibe los siguientes estadios: quistes, metaquiste, trofozoítos, y prequistes. Los quistes, son formas caracterizadas por soportar las adversidades del medio externo. Son expulsados junto con las heces de la persona infectada. Sus dimensiones varían entre 3,5 y 20 micras se encuentran constituidos por una doble membrana; al estar maduros presentan cuatro núcleos y son potencialmente infectantes.
Estos quistes tetranucleados pueden permanecer viables hasta 8 días en heces, en agua o en el suelo a temperatura ambiente, llegando incluso durar hasta más tiempo cuando las temperaturas se encuentran cercanas a los 10º C. Los quistes de Entamoeba histolytica sobreviven a la acción del cloro a las concentraciones usadas para purificar el agua, pero se destruyen a temperaturas mayores de 70º C. El inoculo que da inicio a la infección puede contener de 2.000 a 4.000 quistes, de acuerdo lo reseñado por algunos autores (Flisser, 2006).
Los trofozoítos son de tamaño variable llegando a ostentar hasta 60 micras de diámetro, presentan un citoplasma dividido en dos porciones: endoplasma, donde se encuentra el núcleo y demás organelos y el ectoplasma, de donde derivan las estructuras que permiten la locomoción, conocidas como pseudópodos. El trofozoíto es la forma responsable de la enfermedad en el humano y habita en la región ileo-cecal del intestino grueso, más hacia la región del sigmoides, donde el tránsito fecal se torna enlentecido. El metaquiste y el prequiste se analizarán en detalle en el ciclo de vida.
Entamoeba histolytica es un organismo unicelular que no posee mitocondrias, ni retículo endoplásmico ni aparato de Golgi; los ribosomas se encuentran dispersos o formando pequeños grupos en el citoplasma. Este protozoario se replica por fisión binaria.
[su_spacer size=”25″]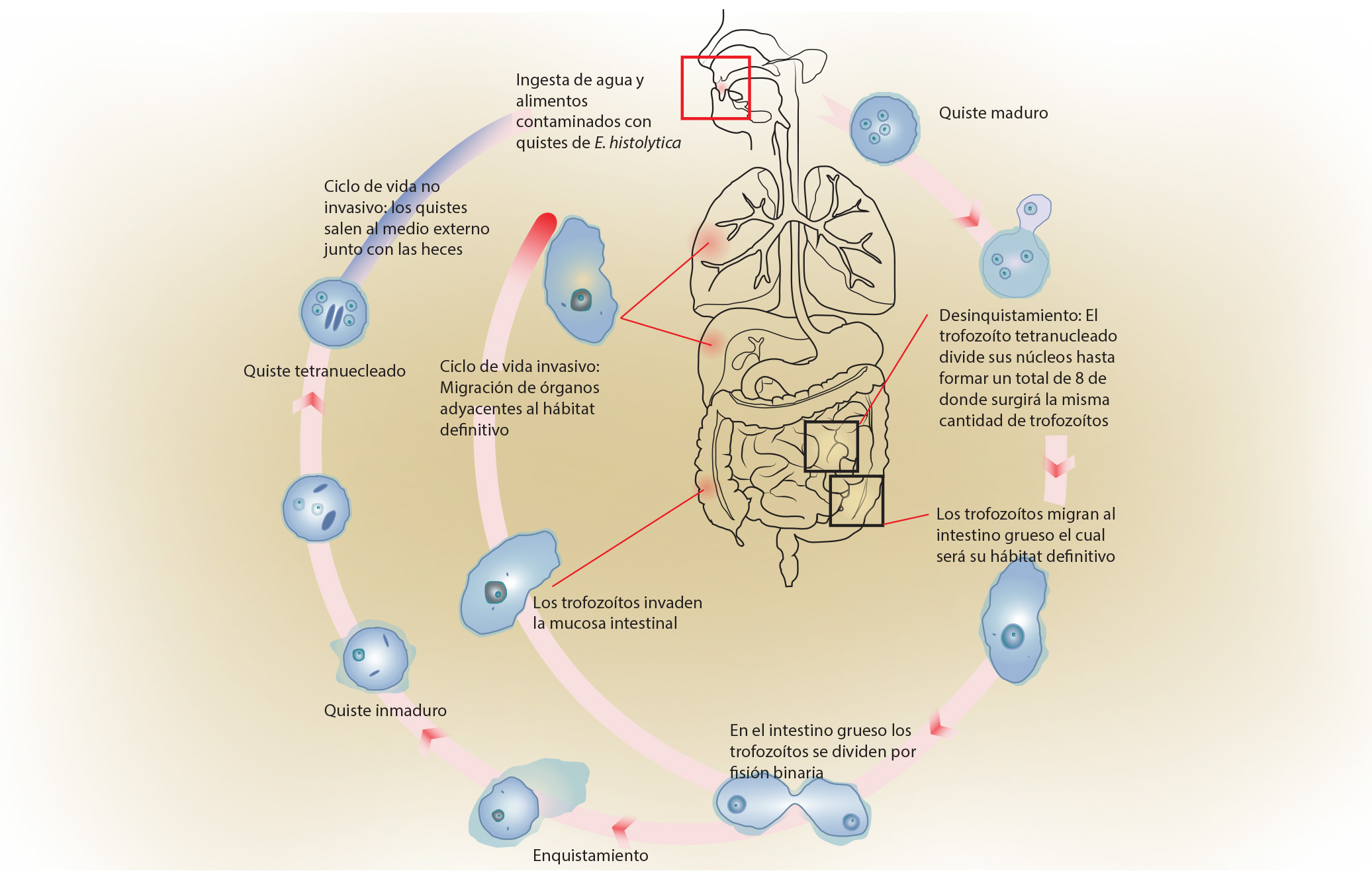
Ciclo de vida Entamoeba histolytica
Tomado y modificado de: aeasyd.blogspot.com
[su_spacer size=”20″]
Ciclo de vida
El hombre adquiere la infección tras la ingesta de quistes tetranucleados en agua y alimentos que se encuentran contaminados. Por acción del pH gástrico se reblandece la doble membrana, los núcleos, que son cuatro, se dividen formando un total de 8 núcleos, posteriormente, cada núcleo se rodea de citoplasma y se escinde constituyendo así trofozoítos metacíclicos. En la luz del intestino se dividen en incontables ocasiones por fisión binaria. Determinada población de trofozoítos disminuye su motilidad, se rodean y disminuyen de tamaño (pre-quistes) secretan una cápsula de quitina y después de dos a tres divisiones del núcleo queda formado el quiste. Esta transformación ocurre en la luz intestinal.
Otra población de trofozoítos, ubicados también en la luz del intestino, se adhiere a la superficie de la submucosa, e invaden tejidos, hasta romper la integridad de la misma, produciendo lesiones ulcerosas que crecen en extensión y profundidad. La progresión de las lesiones permite a los trofozoítos pasar del intestino a las estructuras contiguas y vasos sanguíneos, con lo que se introducen en la circulación enterohepática y llegan al hígado, donde pueden permanecer causando o no lesiones, y pueden dirigirse a otros órganos. Mientras los trofozoítos de Entamoeba histolytica invaden tejido no se multiplican, este fenómeno corresponde a lo que algunos investigadores han denominado “suicidio parasitario”, ya que tampoco salen al medio externo en forma quística para darle continuidad al ciclo de vida.
Patogenia vs virulencia
Entiéndase la patogenicidad como la capacidad que tiene un organismo de producir daño en el paciente, en cuanto que la virulencia es el grado de ese daño, ésta última varía significativamente de acuerdo con las propiedades tanto del parásito como del paciente.
Se han sugerido los siguientes factores moleculares por medio de los cuales Entamoeba histolytica puede causar daño al hospedador: a) lectinas: proteínas de superficie que reconocen carbohidratos, en especial la específica de la galactosa y acetil-N-galactosamina, que participa en el fenómeno de adherencia del parásito a células y a la superficie de la mucosa intestinal, y quizá también en el efecto citotóxico b) ameboporo: péptido no enzimático de 18 kDa que produce canales iónicos en la membrana de ciertas células c) Actividad de colagenasas y fosfolipasa A d) proteasas de cisteína: estas proteasas activan el complemento y ha sido demostrado que participan directamente en la supervivencia de las amebas en tejidos.
Entre los factores del huésped que permiten o no el establecimiento de la infección por amebas, se encuentra: a) Estado nutricional del paciente. b) Presencia de abundante mucina, la misma se unen a la lectina amebiana (adhesina del trofozoíto) inhibiendo la adhesión de la ameba a los tejidos. c) Las proteasas pancreáticas y sales biliares, son otro mecanismo de defensa intestinal que pueden bloquear la adhesión amebiana. d) La presencia de carbohidratos específicos de superficie, cuando existe deficiencia de éstos, el trofozoíto tendrá dificultad o no podrá adherirse.
[su_spacer size=”25″]
 [su_spacer size=”25″]
[su_spacer size=”25″]
Patogenia
En relación a las características antes citadas, en el establecimiento de una infección por amebas intervienen una secuencia de eventos que se describen a continuación. Los trofozoítos tienen la capacidad de atravesar el moco colónico mediante la acción enzimática de mucinasas y protein-kinasas.
La adhesión al epitelio celular se establece mediante adhesinas tipo I, éstas son lectinas que van a reconocer residuos de carbohidratos, como el Gal/Gal Nac de las células blanco, y unirse mediante receptores específicos, ricos en cisteína, de la célula (Kobiler y Mirelman, 1980). Una vez establecido el contacto trofozoíto-célula, entra en acción un péptido denominado ameboporo o ionóforo, que se encuentra dentro de vesículas en el citoplasma del trofozoíto, cuando se da el contacto parásito-célula las vesículas con el ameboporo se transportan hacia la membrana del trofozoíto y difunden hacia la membrana plasmática de la célula huésped, justo en el punto de contacto de las dos células y donde se inicia la producción de poros y canales que provocan la difusión de iones, que generan alteraciones en el intercambio iónico de la célula del paciente. La falta de ATP intracelular origina pérdida del ión K+ con retención de Na+ y agua que induce edema en el citoplasma, aumento de la concentración de calcio (Ca+2) intra-celular con la subsecuente citólisis. El contacto de trofozoítos con los tejidos también provoca destrucción de tejido conectivo a causa de la liberación de enzimas hidrolíticas. Ha sido descrito que al contacto de un trofozoíto con células y tejidos, se dispara una señal que ordena el transporte y liberación de colagenasas y otras enzimas, que destruyen los tejidos, lo cual queda descrito como una potente actividad colagenolítica específica para el colágeno humano tipo I. De allí que histolytica signifique: “que lisa tejidos” En este mecanismo, las proteasas de cisteína disuelven la matriz extracelular de los tejidos; también participan neuramidasas como la glucosidasa que degradan las mucinas colónicas y las glicoproteínas membranales de las células del huésped. Otro producto de los trofozoítos son las fosfolipasas, que producen daño sobre las células del huésped ya que desdoblan los constituyentes fosfolipídicos de las membranas celulares y generan productos líticos por hidrólisis de fosfolípidos propios o de la célula blanco (Romero y Sanchez, 1999).
Clínica
Aunque la enfermedad puede presentarse en 90% asintomática, también puede cursar con dos formas clínicas diferentes: síndrome diarreico y disentería. El síndrome diarreico se caracteriza por dolor colónico moderado y ausencia de tenesmo, diarrea escasa con poca materia fecal y abundante material líquido o mucoide hemorrágico. Por otro lado, la disentería se inicia con mayor número de evacuaciones de materia fecal mezclada con moco y sangre, dolor discreto o moderado acompañado al defecar con tenesmo intenso. Esta forma ambulatoria de la amibiasis intestinal desaparece rápidamente con el tratamiento específico. La amibiasis intestinal es una enfermedad aguda.
El absceso hepático amebiano se caracteriza por la instalación aguda de dolor intenso en la región hepática y en el hipocondrio derecho, irradiado al hombro y a la escápula del mismo lado; el dolor aumenta con la respiración profunda y la tos. Los pacientes con absceso hepático amebiano muestran fiebre elevada y persistente, escalofrío y sudoración nocturna, náusea y diarrea, pero menos de 30% eliminan quistes, trofozoítos, o ambos, de Entamoeba histolytica en las heces. En la exploración física sobresalen la hepatomegalia y el dolor intenso a la palpación de la región hepática.
Epidemiología y prevención
En la amibiasis la persona que se encuentra infectado y que expulsa quistes en sus heces es la principal fuente de infección. Las condiciones de insalubridad, la escasa higiene, la ingesta de agua y alimentos contaminados provenientes de ventas de comida rápida, entre otros, favorecen el riesgo de contraer esta parasitosis.
Por ello la adecuada educación sanitaria en las comunidades es imperante, la misma debe incluir educación higiénica individual que contemple el lavado de manos con agua y jabón antes de comer y después de defecar. Saneamiento ambiental eficiente que incluya proporcionar agua purificada y sistema de drenaje eficiente a la población; eliminación adecuada de la basura en las comunidades; no emplear heces humanas como fertilizantes para las plantas. Detección y tratamiento obligatorio de todos los individuos que eliminen quistes de Entamoeba histolytica en las heces.
Diagnóstico (laboratorio)
Diagnóstico parasitológico: Se realiza mediante examen fresco con solución salina-lugol, con la finalidad de buscar quistes en heces formadas o en su defecto, trofozoítos en heces diarreicas. Igualmente, se pueden realizar exámenes de concentración como el FAUST que es un método de concentración por flotación.
Diagnóstico inmunológico: Existen pruebas específicas, como el inmunoensayo enzimático (ELISA por sus siglas en inglés) en pacientes que han desarrollado amibiasis extraintestinal y que eventualmente que no es posible realizar diagnóstico parasitológico (Fotedar y col., 2007).
Otros dx: Dentro del área de biología molecular se cuenta con la prueba de la PCR (reacción en cadena de polimerasa por sus siglas en inglés) las cuales son muy útiles para identificación de especies (Fotedar y col 2007).
Tratamiento
El tratamiento más efectivo de la infección intestinal asintomática es con paromicina durante ocho días o yodoquinol durante 20 días. Para la enfermedad intestinal amebiana se recomienda el uso combinado de dihidroemetina durante 10 días, seguida de metronidazol durante 5 días a 10 días, aunque pudiese emplearse sólo el metronidazol. Para el absceso hepático amebiano el tratamiento médico óptimo es metronidazol oral durante 10 días, peor en casos graves puede usarse combinado con emetina y hasta administrarse por vía intravenosa (Flisser, 2006).
La realidad de otras amebas
Existen otro grupo de amebas que pueden encontrarse en el intestino y que si bien son inocuas, consideradas comensales en términos biológicos, para el profesional de la salud deben constituir un llamado de alerta, debido a que son indicadores epidemiológicos de contaminación fecal. Entre este grupo de comensales podemos citar: E. coli, Endolimax nana, Iodamoeba bütschlii, Dientamoeba fragilis; siendo disímiles, morfológicamente, a Entamoeba histolytica.
Dentro de este grupo no patógeno también figura Entamoeba dispar, sin embargo, su importancia biológica radica en que es indistinguible morfológicamente de Entamoeba histolytica, tanto por microscopía de luz como por microscopia electrónica, principalmente por presentar quistes tetranucleados.
Entamoeba dispar fue descrita en 1925 por Brumpt, quien la distinguió de Entamoeba histolytica por dos características: i) no es patógena para el hombre, pero si para el gato. ii) no presenta eritrofagocitosis. El diagnóstico diferencial en el examen coproparasitológico en fresco no es posible, por eso se le sugiere al jefe de laboratorio reportar el examen como: Entamoeba histolytica / Entamoeba dispar. Sin embargo, los factores moleculares, que han permitido establecer diferencias entre Entamoeba histolytica y Entamoeba dispar han sido tanto los marcadores de patogenicidad como los marcadores de virulencia, encontrándose únicamente en la especie patógena.
Referencias
- Fotedar y col. 2007. Laboratory Diagnostic Techniques for Entamoeba Species. CLINICAL MICROBIOLOGY REVIEWS 20 (3): 511–532.
- Haque, R., and W. A. Petri, Jr. 2006. Diagnosis of amebiasis in Bangladesh. Archives of Medical Research. 37:273–276.
- Kobiler, D. y Mirelman, D. 1980. Lectin activity in Entamoeba histolytica trophozoites. Infection and Immunity 29: 221-225.
- Flisser, A. y Pérez, R. 2006. Aprendizaje de la parasitología basado en problemas. Editores de textos Mexicanos, México.
- Romero y Sánchez, 1999. Amibiasis. Grupo editorial Mundo México. México.
- World Health Organization. 1997. World Health Organization/Pan American Health Organization/UNESCO report of a consultation of experts on VOL. 20, 2007 LABORATORY DIAGNOSTIC TECHNIQUES FOR ENTAMOEBA SPECIES 531 Downloaded from cmr.asm.org by on February 10, 2009 amebiasis. Wkly. Epidemiol. Rec. 72:97–99.

