Optimización de los inhibidores de la bomba de protones
Farmacocinética y Enfermedades relacionadas con el ácido
Los inhibidores de la bomba de protones (IBP) fueron Introducidos por primera vez a fines de la década de 1980 y son un tratamiento primario para los trastornos relacionados con el ácido.
Actualmente los IBP aprobados por la Administración de Drogas y Alimentos de los Estados Unidos y la Agencia Europea de Medicamentos incluyen omeprazol, lansoprazol, pantoprazol, rabeprazol, esomeprazol, 1,2 y más reciente están los P-CAB (Vonoprazan) aprobado en: Japón para ERGE, Enfermedad Ulcero Péptica y para tratamiento del Helicobacter pylori (Hp) 3, en USA para la terapía dual y triple de Hp 4. Además, en Malasia, Filipina, Singapur, Perú, Brasil, México, China, Ecuador y Taiwán.
Los IBP son profármacos derivados del timoprazol, un compuesto de piridilmetilsulfinil benzimidazol capaz de bloquear irreversiblemente la bomba de protones (H/K ATPasa) de las células parietales gástricas, como la bomba de protones es el último paso en la secreción de ácido en el estómago, son el objetivo ideal para la inhibición de ácido.5
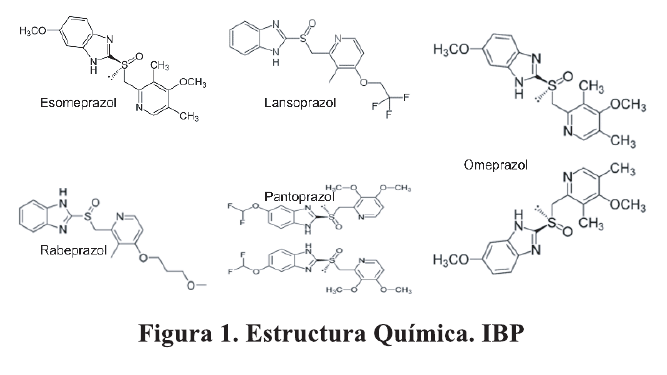
Desde el descubrimiento del omeprazol se han desarrollado y comercializado varios análogos. Se desarrollaron primeros omeprazol, lansoprazol y pantoprazol (IBP de primera generación) y varios estudios demostraron sus propiedades antiácidas y su papel en la erradicación de Helicobacter. Pylori (Hp). Más tarde, se presentó una segunda generación de IBP (rabeprazol y esomeprazol) que demostró una inhibición ácida aún mayor. 6-8 . Figura 1.
En relación con los IBP, su eficacia está relacionada con la dosis, la formulación, la potencia relativa, la frecuencia de administración y las diferencias genéticas en la actividad de las enzimas del citocromo P450 (CYP) de los sujetos que toman el fármaco.
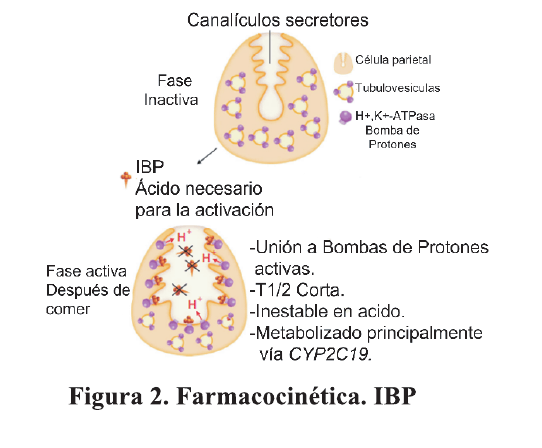
El metabolismo hepático de los IBP es un parámetro relevante ya que los IBP al ser profármacos se metabolizan rápidamente. Las principales enzimas involucradas en el metabolismo de los IBP son CYP2C19 y CYP3A4. Existen diferencias genéticas en la actividad de CYP2C19. Los pacientes que producen la mayor cantidad de esta enzima se denominan metabolizadores extensos homocigóticos (HomEM), los metabolizadores extensos heterocigóticos (HetEM) son portadores de un alelo de tipo salvaje y uno de tipo mutado. Por otra parte, los pacientes denominados metabolizadores lentos (PM) tienen dos alelos variantes de pérdida de función. 9
Las propiedades farmacocinéticas de los IBP tienen una diferencia significativa entre PM y HomEM, que tiene una significancia clínica importante en especial cuando se estudia la efectividad de los IBP en el tratamiento de Hp, se encontró que los pacientes con PM tienen una tendencia hacia una mejor tasa de erradicación de Hp cuando el tratamiento contenía IBP de primera generación, mientras que los pacientes con HomEM obtuvieron tasas de erradicación más altas con regímenes de terapia basados en IBP de nueva generación 10. Las posibles explicaciones pueden ser que el CYP2C19 no tiene un efecto significativo en las terapias triples de erradicación basadas en rabeprazol o esomeprazol.
De hecho, el rabeprazol se metaboliza a través de una vía no enzimática, con escasa participación de CYP2C1911 yesomeprazol tiene un metabolismo de primer paso mínimo caracterizado por una hidroxilación deficiente a través de CYP2C19 12. Figura 2.
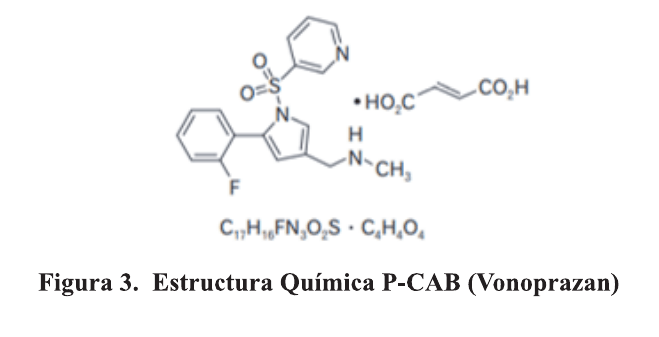
Con respecto a los P-CAB, son un inhibidor competitivo de H+/K+-ATPasa presente en la membrana luminal de las células parietales gástricas. El poder de unión es mucho más potente que el de los IBP convencionales, por ejemplo, su actividad biológica es 300 veces mayor que la del lansoprazol. 13,14 . Figura 3
Los P-CAB tiene beneficios farmacológicos adicionales sobre otros IBP: no requiere activación farmacológica por parte del ácido gástrico para inhibir la secreción de ácido y tiene una vida media más prolongada debido a su cinética de disociación lenta de la bomba de protones 15 además, a diferencia de los IBP que inhiben a las bombas activas los P-CAB inhiben tanto a las bombas activas como a la inactivas. Figura 4.
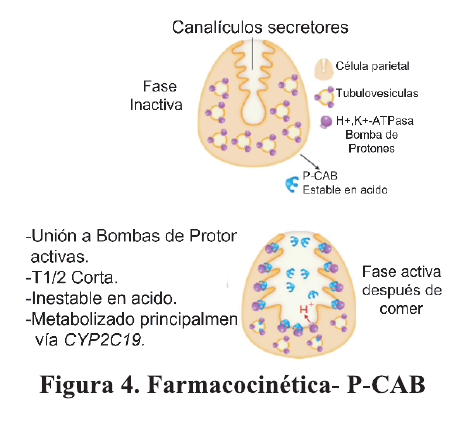
Otra peculiaridad de los P-CAB consiste en el rápido inicio del efecto: mientras que los IBP suelen requerir más de 75-100 h para lograr el máximo efecto inhibidor del ácido gástrico 16,17, los P-CAP logran una inhibición del ácido gástrico rápida, potente y duradera 18.
Por lo tanto, al comparar la Farmacocinética de los IBP y los P-CAB (Vonoprazan), estos últimos parecen ser mejor que los IBP convencionales por varias razones: es más potente en el bloqueo de la secreción de ácido, tiene un inicio de acción rápido, es menos propenso a las variables de metabolización debido a los polimorfismos del citocromo, mayor seguridad y mejor tolerabilidad 19.
Como se planteó al inicio, el objetivo de bloquear a la bomba de protones es su uso, en el tratamiento primario para los trastornos relacionados con el ácido y esto es precisamente lo que se requiere para el tratamiento de erradicación del Hp, una fuerte inhibición de la secreción de ácido gástrico.
Cuando se evalúa la tasa de erradicación de diferentes regímenes, la administración de la dosis más alta de IBP, parece ser capaz de mejorar el resultado terapéutico, sin embargo, la elección de la molécula de IBP podría tener cierto peso, ya que los IBP de segunda generación probablemente sean más efectivas porque su metabolismo depende menos de las variables genéticas CYP2C19.
Hasta el momento los P-CAB (Vonoprazan) ha mostrado la mayor eficacia, siendo los datos actuales muy prometedores.
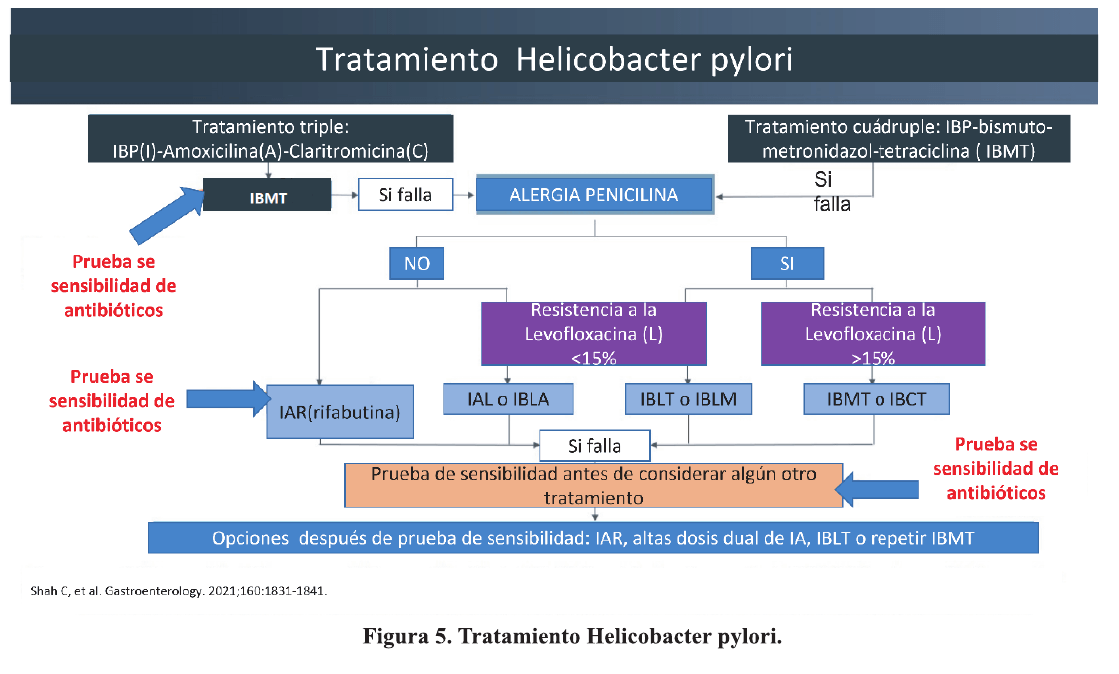
En la era de la resistencia a los antibióticos, las estrategias para mejorar la tasa de erradicación están disminuyendo 20. Hasta que se descubran nuevos antibióticos, una adecuada elección de combinación de antibióticos puede guiarse por un enfoque personalizado basado en el conocimiento de la susceptibilidad a los mismos. 21-24. Figura 5.
Referencia Bibliográficas
- Strand DS, Kim D, Peura DA. 25 años de inhibidores de la bomba de protones: una revisión exhaustiva. Gut Liv .2017;11:27-37.
- Jaynes M, Kumar AB. Los riesgos del uso a largo plazo de los inhibidores de la bomba de protones: una revisión crítica.Ther Adv Drug Safe . 2019;10:2042098618809927.
- FDA 2022. Accessea May 15, 2022. www.acessdata.fda.grv.
- Babael-Aziz et al.Aliment Pharm Therap. 2021;53:790-809
- Gomollon F, Calvet X. Optimising acid inhibition treatment. Drugs 2005; 65 (Suppl. 1): 25-33
- Kirchheiner J, Glatt S, Fuhr U, et al. Relative potency of proton-pump inhibitors-comparison of effects on intragastric pH. Eur J Clin Pharmacol 2009; 65: 19- 31.
- McKeage K, Blick SK, Croxtall JD, et al. Esomeprazole: a review of its use in the management of gastric acid-related diseases in adults. Drugs 2008; 68: 1571- 607.
- Baldwin CM, Keam SJ. Rabeprazole: a review of its use in the management of gastric acid-related diseases in adults. 2009; 69: 1373- 401.
- Tomalik-Scharte D, Lazar A, Fuhr U, Kirchheiner J. The clinical role of genetic polymorphisms in drug-metabolizing enzymes. Pharmacogenomics J. 2008;8:4-15.
- Kuo CH, Lu CY, Shih HY, Liu CJ, Wu MC, Hu HM, Hsu WH, Yu FJ, Wu DC, Kuo FC. CYP2C19 polymorphism influences Helicobacter pylori eradication. World J Gastroenterol. 2014;20:16029-16036.
- Adachi K, Katsube T, Kawamura A, Takashima T, Yuki M, Amano K, Ishihara S, Fukuda R, Watanabe M, Kinoshita Y. CYP2C19 genotype status and intragastric pH during dosing with lansoprazole or rabeprazole. Aliment Pharmacol Ther. 2000;14:1259-1266.
- Andersson T, Hassan-Alin M, Hasselgren G, Miss K, Weidolf L. Pharmacokinetic studies with esomeprazole, the (S)-isomer of omeprazole. Clin Pharmacokinet. 2001;40:411-426.
- Parsons ME, Keeling DJ. Novel approaches to the pharmacological blockade of gastric acid secretion. Expert Opin Investig Drugs. 2005;14:411-421.
- Ashida K, Sakurai Y, Hori T, Kudou K, Nishimura A, Hiramatsu N, Umegaki E, Iwakiri K. Randomised clinical trial: Vonoprazan, a novel potassium-competitive acid blocker, vs. lansoprazole for the healing of erosive Drugs oesophagitis. Aliment Pharmacol Ther. 2016;43:240-251.
- Scott DR, Munson KB, Marcus EA, Lambrecht NW, Sachs G. The binding selectivity of vonoprazan (TAK-438) to the gastric H+, K+ -ATPase. Aliment Pharmacol Ther. 2015;42:1315-1326.
- Saitoh T, Fukushima Y, Otsuka H, Hirakawa J, Mori H, Asano T, Ishikawa T, Katsube T, Ogawa K, Ohkawa S. Effects of rabeprazole, lansoprazole and omeprazole on intragastric pH in CYP2C19 extensive metabolizers. Aliment Pharmacol Ther. 2002;16:1811-1817.
- Sugimoto M, Furuta T, Shirai N, Ikuma M, Hishida A, Ishizaki T. Initial 48-hour acid inhibition by intravenous infusion of omeprazole, famotidine, or both in relation to cytochrome P450 2C19 genotype status. Clin Pharmacol Ther. 2006;80:539-548.
- Jenkins H, Sakurai Y, Nishimura A, Okamoto H, Hibberd M, Jenkins R, Yoneyama T, Ashida K, Ogama Y, Warrington S. Randomised clinical trial: Safety, tolerability, pharmacokinetics and pharmacodynamics of repeated doses of TAK-438 (vonoprazan), a novel potassium-competitive acid blocker, in healthy male subjects. Aliment Pharmacol Ther. treatment approach for Helicobacter pylori infection: Review of the literature. World J Gastroenterol. 2014;20:5205-5211. Treatment: A Lesson From Japan or a Limited Geographic Phenomenon? Front Pharmacol. 2019;10:316.
- Abadi ATB, Ierardi E. Vonoprazan and Helicobacter pylori Treatment: A Lesson From Japan or a Limited Geographic Phenomenon? Front Pharmacol. 2019;10:316.
- Iannone A, Giorgio F, Russo F, Riezzo G, Girardi B, Pricci M, Palmer SC, Barone M, Principi M, Strippoli GF, Di Leo A, Ierardi E. New fecal test for non-invasive Helicobacter pylori detection: A diagnostic accuracy study. World J Gastroenterol. 2018;24:3021-3029.
- Ierardi E, Giorgio F, lannone A, Losurdo G, Principi M, Barone M, Pisani A, Di Leo A. Noninvasive molecular analysis of Helicobacter pylori: Is it time for tailored first-line therapy? World J Gastroenterol. 2017;23:2453-2458.
- Giorgio F, Ierardi E, Sorrentino C, Principi M, Barone M, Losurdo G, lannone A, Giangaspero A, Monno R, Di Leo A. Helicobacter pylori DNA isolation in the stool: An essential pre-requisite for bacterial noninvasive molecular analysis. Scand J Gastroenterol. 2016;51:1429-1432.
- Cammarota G, Ianiro G, Bibbó S, Di Rienzo TA, Masucci L, Sanguinetti M, Gasbarrini A. Cultureguided 2015;41:636-648.
- Shah C, et al. AGA Clinical Practice Update on the Management of Refractory Helicobacter pylori Infection: Expert Review. Gastroenterology.2021 ;161 : 1831 -1841.